
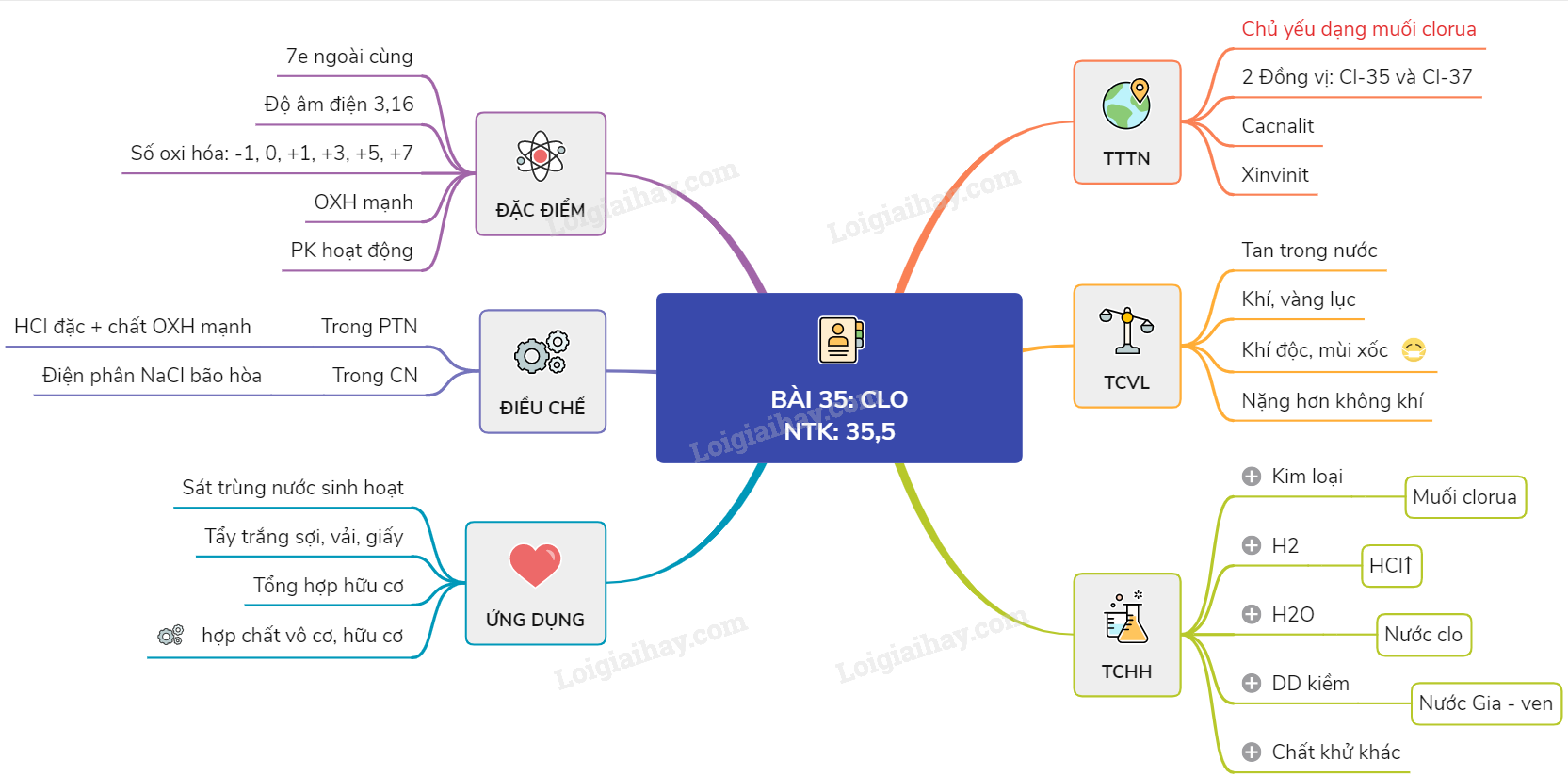
Lý thuyết về Clo
I. Tính chất vật lí
- Ở điều kiện thường, Clo là chất khí màu vàng lục, mùi sốc, rất độc
- Nặng gấp 2,5 lần không khí và tan trong nước. Dung dịch của khí Clo trong nước gọi là nước Clo có màu vàng nhạt
- Khí Clo tan nhiều trong các dung môi hữu cơ như benzene, etanol, hexan
II. Tính chất hóa học
- Tính chất hóa học cơ bản của Clo là tính oxi hóa mạnh
1. Tác dụng với kim loại
Clo tác dụng với hầu hết các kim loại sinh ra muối clorua
2Na + Cl2 ( to) 2NaCl
2Fe + 3Cl2 ( to) 2FeCl3
Lưu ý: Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm; tốc độ nhanh và tỏa nhiều nhiệt
2. Tác dụng với hiđro
- Ở nhiệt độ thường, khí clo không phản ứng với hiđro
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy thì phản ứng xảy ra nhanh và có thể nổ ( mạnh nhất khi tỉ lệ mol là 1:1)
({{overset{0}{mathop{H}},}_{2}}+{{overset{0}{mathop{Cl}},}_{2}}to overset{+1}{mathop{text{ }H}},overset{-1}{mathop{Cl}},)
3. Tác dụng với nước
- Một phần khí Clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipocloro có tính tẩy màu mạnh do có (Hoverset{+1}{mathop{Cl}},O) là chất oxh rất mạnh.
({{overset{0}{mathop{Cl}},}_{2}}+{{H}_{2}}Orightleftarrows Hoverset{-1}{mathop{Cl}},+Hoverset{+1}{mathop{Cl}},O)
=> Khi clo tan trong nước, diễn ra cả hiện tượng vật lý và hiện tượng hóa học.
4. Tác dụng với dung dịch kiềm
Cl2 + 2NaOH (xrightarrow{{{t}^{o}},,thddot{o}hat{o}ng}) NaCl + NaClO + H2O
=> Dung dịch chứa đồng thời NaCl và NaClO gọi là nước Gia-ven
5. Tác dụng với một số hợp chất có tính khử
Cl2 + 2FeCl2 (xrightarrow{{{t}^{o}}}) 2FeCl3
Cl2 + H2S (xrightarrow{{{t}^{o}}}) 2HCl + S
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
Cl2 + SO2 + 2H2O → 2HCl + H2SO4
Cl2 + 2NaBr → 2NaCl + Br2
* Nhận xét:
- Khi tham gia phản ứng với H2, kim loại và các chất khử, clo đóng vai trò là chất OXH
- Khi tham gia phản ứng với H2O và dung dịch kiềm, Clo đóng vai trò vừa là chất OXH vừa là chất Khử.
III. Điều chế
1.Trong phòng thí nghiệm: dùng các chất có tính oxi hóa mạnh tác dụng với axit HCl đặc
(begin{gathered} Mn{O_2} + 4HClxrightarrow{{{t^o}}}MnC{l_2} + C{l_2} + 2{H_2}O hfill 2KMn{O_4} + 16HCl to 2MnC{l_2} + 2KCl + 5C{l_2} + 8{H_2}O hfill end{gathered} )
2. Trong công nghiệp: điện phân dung dịch bão hòa muối ăn trong nước để sản xuất xút, đồng thời thu được khí Clo và hiđro
(2NaCl + 2{H_2}Oxrightarrow{{điện phân dung {text{dịch có màng ngăn}}}}2NaOH + {H_2} + C{l_2})
IV. Ứng dụng
- Dùng để diệt trùng nước sinh hoạt, nước bể bơi để diệt 1 số vi khuẩn gây bệnh
- Dùng để tẩy trắng sợi, giấy, vải,…
- Dùng để sản xuất chất hữu cơ, chất tẩy trắng, chất sát trùng như nước Gia ven , clorua vôi và sản xuất hóa chất vô cơ như axit clohiđric, kaliclorat
Sơ đồ tư duy: Clo
Loigiaihay.com
Link nội dung: https://blog24hvn.com/hoa-hoc-10-a44568.html