
Etilen: Định nghĩa, công thức cấu tạo, tính chất, cách điều chế và ứng dụng
Etilen là gì?
Etilen (hay còn gọi là Ethylene) là một chất khí có trong các loại hidrocacbon. Đồng thời, Etilen cũng là một anken (alkene) đơn giản nhất có công thức hóa học là C2H4 (hay CH2=CH2).
Nhắc đến Etilen, người ta sẽ nghĩ ngay đến công dụng làm cho chuối chín nhanh. Công dụng được biết đến đầu tiên của etilen đó chính là khả năng kích thích quả chín. Ngay sau đó, nhiều nhà khoa học đã nghiên cứu về loại khí này và chứng minh etilen được sinh ra từ thành phần thực vật, đặc biệt là các loại quả.
Hiện nay, Etilen C2H4 được ứng dụng trong công nghiệp chất dẻo, là nguyên liệu điều chế polietilen. Đây là hợp chất quan trong được ứng dụng nhiều trong sản xuất.
-
Công thức phân tử: C2H4
-
Phân tử khối: 28
-
Công thức cấu tạo của C2H4:
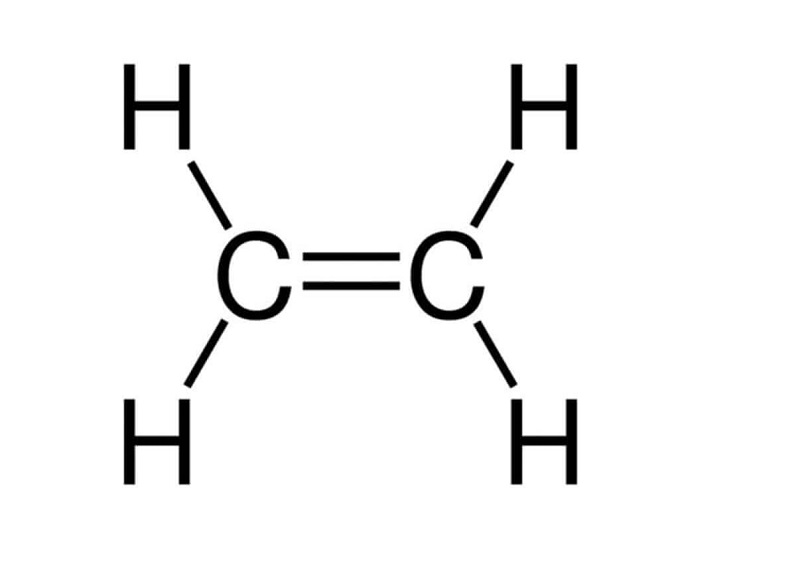
- Trong công thức cấu tạo C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
- Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ đứt ra trong các phản ứng hóa học.
- Những hiđrocacbon mạch hở, trong phân tử có một liên kết đôi như etilen gọi là anken, có công thức chung CnH2n với n ≥ 2.
Etilen (C2H4) có liên kết gì?
Etilen (C2H4) có liên kết gì? Phân tử C2H4 có 4 liên kết đơn C-H và 1 liên kết đôi C=C.
Trong đó:
- Liên kết C-H là liên kết cộng hóa trị không phân cực, trong đó hai nguyên tử H dùng chung một cặp electron với nguyên tử C.
- Liên kết C=C là liên kết cộng hóa trị phân cực, trong đó hai nguyên tử C dùng chung hai cặp electron và một cặp electron còn lại lệch về nguyên tử C có độ âm điện lớn hơn là C (2,55) so với H (2,2).
Etilen có tính chất vật lý nào?
Nhìn vào công thức của Etilen, có thể thấy đây là chất khí, không màu, không mùi, nhẹ hơn không khí (d= 28/29), ít tan trong nước. Etilen cũng rất dễ bắt cháy và có mùi ngọt nhẹ của xạ hương.

Etilen tan ít trong nước nhưng tan nhiều trong ete và một số dung môi hữu cơ.
Để nhận biết khí etilen, người ta dùng các phương pháp:
-
Dẫn khí etilen qua dung dịch brom (dung dịch có màu cam), quan sát thấy dung dịch brom bị mất màu.
-
Dẫn khí etilen qua dung dịch kali pemanganat, quan sát thấy dung dịch kali pemanganat bị mất màu.
Tính chất hóa học của Etilen
Etilen (C2H4) là một hiđrocacbon không no nằm trong dãy đồng đẳng của anken. Etilen tác dụng được với rất nhiều chất ở nhiều dạng khác nhau như: Oxy, dung dịch brom, phản ứng trùng hợp của etilen C2H4,… Đây là một chất khí có thể tham gia phản ứng ở nhiều dạng khác nhau.
Tính cháy (Tác dụng với oxi)
-
Tương tự metan, khi đốt etilen cháy hoàn toàn tạo ra khí cacbonic (CO2), hơi nước (H2O) và phản ứng tỏa nhiều nhiệt.
-
Phương trình phản ứng:
C2H4 + 3O2 → 2CO2 + 2H2O (nhiệt độ)
Phản ứng cộng với dung dịch Brom
Thí nghiệm: Dẫn khí etilen qua dung dịch brom màu da cam đựng trong ống nghiệm.
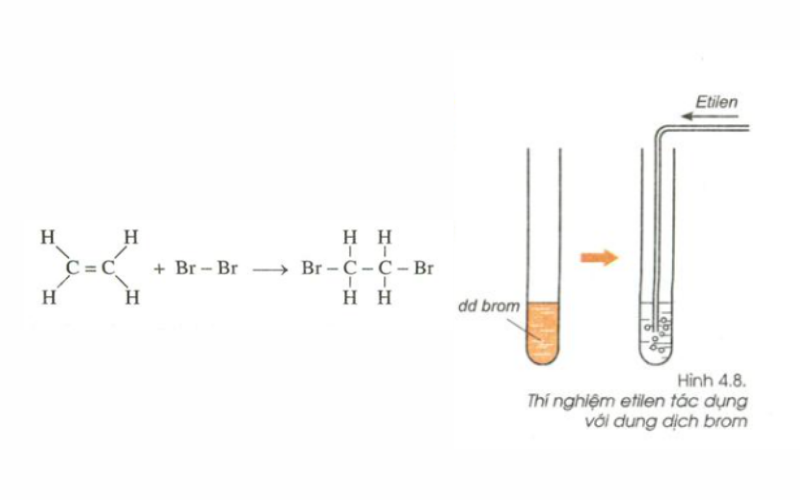
Hiện tượng:
- Ban đầu dung dịch brom có màu da ca
- Sau khi dẫn khí etilen vào thấy dung dịch brom bị mất màu.
Nhận xét: Etilen đã phản ứng với brom trong dung dịch. Ta có PTHH của phản ứng:
CH2= CH2 (k) + Br2 (dd) → Br - CH2 - CH2 - Br (l)
Kết luận:
- Như vậy, liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom. Phản ứng trên được gọi là phản ứng cộng.
- Ngoài brom, trong những điều kiện thích hợp, etilen còn có phản ứng cộng với một số chất khác, như hidro, clo. Nhìn chung, các chất có liên kết đôi (tương tự etilen) dễ tham gia phản ứng cộng.
Phản ứng với clo
CH2 = CH2 + Cl2 → CH2=CH2Cl - HCl
Phản ứng cộng hidro
C2H4 +H2 → C2H6
Phản ứng cộng axit
CH2= CH2 + HCl (khí) → CH3CH2Cl
C2H4 + HBr → C2H5Br
Phản ứng cộng nước (có điều kiện nhiệt độ và sự xúc tác của axit)
C2H4 + H2O → C2H5OH
Phản ứng trùng hợp
Trong điều kiện thích hợp (nhiệt độ, áp suất, xúc tác), liên kết kém bền trong phân tử etilen bị đứt ra, dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo thành phân tử có kích thước và khối lượng rất lớn, gọi là polietilen (viết tắt là PE).
PE là chất rắn, không độc, không tan trong nước, là nguyên liệu quan trọng trong công nghiệp chất dẻo.
…+ CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + … → … - CH2 - CH2 - CH2 - CH2 - CH2 - CH2 -… (điều kiện xúc tác áp suất, nhiệt độ)
Đây được gọi là phản ứng trùng hợp.
XÂY DỰNG NỀN TẢNG TOÁN HỌC VỮNG CHẮC CHO TRẺ TỪ NHỎ VỚI ĐA PHƯƠNG PHÁP DẠY HỌC TÍCH CỰC, CHI PHÍ CỰC RẺ CHƯA ĐẾN 2K/NGÀY CÙNG MONKEY MATH.

Điều chế Etilen như thế nào?
Etilen thường được điều chế và ứng dụng nhiều nhất trong hai môi trường phổ biến: Phòng thí nghiệm và trong công nghiệp.

Điều chế Etilen trong phòng thí nghiệm
Trong phòng thí nghiệm, etilen được điều chế bằng cách đun etanol với axit sunfuric đậm đặc theo sơ đồ:
CH3CH2OH → CH2=CH2 + H2O (H2SO4, nhiệt độ)
Điều chế Etilen trong công nghiệp
Trong công nghiệp, etilen được điều chế bằng phản ứng tách hiđro từ ankan tương ứng hoặc bằng phản ứng craking.
Xem thêm:
- Dầu mỏ là gì? Thành phần và những ứng dụng nổi bật
- Benzen: Đặc điểm tính chất, cấu tạo và ứng dụng
Etilen có vai trò gì? Các ứng dụng nổi bật của Etilen
Etilen ứng dụng và có mặt ở rất nhiều lĩnh vực khác nhau trong cuộc sống. Trong đó, ứng dụng Etilen nổi bật nhất trong các ngành đặc trưng như: Sinh học, công nghiệp và nông nghiệp.

Trong công nghiệp
Trong công nghiệp, etilen là nguyên liệu quan trọng được ứng dụng triệt để:
-
Công nghiệp tổng hợp polime cùng nhiều chất hữu cơ khác.
-
Có thể tổng hợp các chất hữu cơ thiết yếu khác nhau từ ethylene như etanol, etilen glicol…
-
Ứng dụng trong sản xuất bao bì, dệt may, điện tử.
-
Nguyên liệu trong sản xuất vật liệu xây dựng chất phú, chất kết dính.
-
Sử dụng cho ngành hóa dầu, dẫn xuất.
Trong nông nghiệp
-
Etilen làm tăng sự sinh trưởng của các tế bào thực vật.
-
Dùng trong kích thích sự nảy mầm và sinh trưởng của các loại cây trồng, cây cối.
-
Giúp tăng năng suất cây trồng, phục vụ cho các ngành nông nghiệp trồng trọt, canh tác
-
Đặc biệt, etilen được ứng dụng trong việc kích thích quả mau chín.
Trong sinh học
-
Etilen cùng quá trình chín của trái cây: Dưới tác động của etilen, trái cây chín nhanh hơn. Để làm chậm quá trình chín của quả, người ta sẽ hạn chế sự tổng hợp etilen bằng cách rút dần khí này theo độ chín của quả hoặc hạ thấp nhiệt độ cùng giảm độ thoáng.
-
Etilen cùng hiện tượng rơi rụng: Hiện tượng rụng của các bộ phận cây (hoa, quả, cành, lá) được bắt đầu từ sự gãy cuống. Sự gãy cuống phụ thuộc vào tương quan của etilen và auxin. Etilen kích thích còn auxin lại ức chế lại sự rơi rụng.
-
Etilen và sự ứng động: Etilen cùng auxin cũng gây hiện tượng vận động cảm ứng ở thực vật, trong đó auxin tác động gián tiếp thông qua cảm ứng sự tổng hợp etilen.
-
Etilen và sự nảy mầm, chối của một số loài cây: Etilen làm tăng tốc độ nảy mầm của một số loài cây. Đôi khi, etilen được dùng để thúc đẩy sự nảy mầm của khoai tây và các loại căn hành.
-
Etilen và sự cảm ứng ra hoa: Etilen là thành phần cơ bản trong khối gia tăng quá trình trổ hoa. Etilen được ứng dụng để ức chế trổ hoa trong một vài trường hợp, tuy nhiên nó có ảnh hưởng đến sự kích thích trong cây dứa, xoài và vải. Đối với những cây đơn tính, etilen có khả năng thay đổi giới tính của hoa đang phát triển...
Phân biệt etilen với etan, axetilen
Để phân biệt các chất etilen, etan và axetilen đơn giản nhất, ta cần chọn thuốc thử cho ra hiện tượng khác nhau giữa các chất.
Phân biệt Etilen với etan
Để phân biệt 2 bình chứa khí etan và etilen, có thể dùng thuốc thử là dung dịch Br2
-
Chất làm mất màu dung dịch Br2 là Etilen (CH2=CH2).
-
Chất không làm mất màu dung dịch Br2 là Etan (CH3-CH3).
Phân biệt Etilen với axetilen
Để phân biệt 2 bình chứa khí etilen và axetilen, có thể dùng thuốc thử là AgNO3/ NH3
-
C2H2 là ank-1-in (ankin có nối ba đầu mạch) phản ứng với AgNO3/ NH3 tạo kết tủa vàng nhạt
Phương trình: CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg + 2NH4NO3
-
C2H4 là anken không phản ứng với AgNO3/ NH3
Bài tập về Etilen SGK hóa học 9 kèm lời giải
Từ những kiến thức về etilen trên, các bạn cùng vận dụng những kiến thức đó để giải một số bài tập cơ bản trong SGK hóa học 9 sau.

Giải Bài 1 trang 119 SGK Hóa 9
Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a) CH3 - CH3.
b) CH2 = CH2.
c) CH2 = CH - CH = CH2.
Gợi ý đáp án:
a) CH3 - CH3 có 1 liên kết đơn C - C.
b) CH2 = CH2 có 1 liên kết đôi: C = C.
c) CH2 = CH - CH = CH2 có 2 liên kết đôi: C = C; 1 liên kết đơn: C - C.
Giải bài 3 SGK Hóa 9 trang 119
Hãy nêu phương pháp hóa học loại bỏ khí etilen có sẵn trong khí metan để thu được metan tinh khiết.
Gợi ý đáp án:
Dẫn hỗn hợp qua dung dịch brom dư, khi đó etilen phản ứng tạo thành đibrometan là chất lỏng ở lại trong dung dịch và chỉ có metan thoát ra.
CH2 = CH2 + Br2 → Br - CH2 - CH2 - Br.
Giải Bài 4 trang 119 SGK Hóa 9
Để đốt cháy 4,48 lít khí etilen cần phải dùng:
a) Bao nhiêu lít oxi?
b) Bao nhiêu lít không khí chứa 20% thể tích oxi? Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Gợi ý đáp án:
a) Phương trình phản ứng cháy etilen:
C2H4 + 3O2 → 2CO2 + 2H2O
nC2H4 = 4,48/22,4 = 0,2 mol.
Theo phương trình: nO2 = 3 x nC2H4 = 0,2 x 3 = 0,6 mol.
VO2 = 0,6 x 22,4 = 13,44 lít.
b) Thể tích không khí = (13,44 x 100)/20 = 67,2 lít.
Bài tập về Etilen để học sinh tự luyện
Ngoài bài tập trong sách giáo khoa, dưới đây là một số bài tập mà Monkey tổng hợp để các em có thể cùng nhau luyện tập:
Câu 1: Khí etilen bị lẫn tạp chất là CO2, trình bày phương pháp hóa học để thu được etilen tinh khiết?
Câu 2: Trùng hợp 1 mol etilen (với hiệu suất 80 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là bao nhiêu?
A. 35,0 gam.
B. 14,0 gam.
C. 28,0 gam.
D. 22,4 gam.
Câu 3: Đốt cháy hoàn toàn V lít khí etilen ở điều kiện tiêu chuẩn. Sau đó dẫn sản phẩm phản ứng qua bình đựng lượng dư nước vôi trong thấy thu được 10 gam kết tủa. Giá trị của V là bao nhiêu?
A. 1,12 lít.
B. 1,68 lít.
C. 2,24 lít.
D. 3,36 lít.
Câu 4: Hóa chất thường dùng để phân biệt metan và etilen là
A. H2.
B. O2.
C. Br2.
D. CO2.
Câu 5: Dẫn 5,6 lít hỗn hợp khí ở điều kiện tiêu chuẩn gồm: metan và etilen qua bình đựng lượng dư brom thấy khối lượng bình tăng 2,8 gam. Thể tích khí metan (đktc) trong hỗn hợp là
A. 0,336 lít.
B. 3,360 lít.
C. 0,224 lít.
D. 2,240 lít.
Câu 6: Trùng hợp 14 gam etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Câu 7: Chất nào sau đây có thể làm mất màu dung dịch brom ở điều kiện thường?
A. CO2.
B. C2H4.
C. CH4.
D. C2H5OH.
Câu 8: Cho 11,2 lít etilen (đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là:
A. 40%
B.50%
C.45%
D.55%
Câu 9: Đốt cháy hoàn toàn 2,24 lít hợp chất hữu cơ A thuộc cùng dãy đồng đẳng etilen, sau đó dẫn sản phẩm cháy lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 đựng Ca(OH)2 dư. Thấy khối lượng bình 1 tăng 5,4 gam. Công thức phân tử A là
A. C3H6.
B. C4H8.
C. C5H10.
D. C2H6.
Câu 10: Dẫn 2,8 lít hỗn hợp gồm metan và etilen (ở đktc) qua lượng dư dung dịch brom thấy thu được 4,7 gam đibrometan. Phần trăm thể tích khí metan trong hỗn hợp ban đầu là
A. 20%.
B. 40%.
C. 80%.
D. 60%.
Câu 11: Cho V lít hỗn hợp khí gồm CH4 và C2H4 đi qua dung dịch brom thấy có 16 gam brom phản ứng. Mặt khác, đem đốt cháy V lít hỗn hợp trên thì thu được 6,72 lít CO2 và 7,2 gam nước. Tính V và % thể tích CH4 trong hỗn hợp ban đầu (biết các thể tích đo ở đktc)
A. 4,48 lít và 50%.
B. 6,72 lít và 75%.
C. 4,48 lít và 75%.
D. 6,72 lít và 50%.
Câu 12: Đốt cháy V lít etilen thu được 9 gam hơi nước. Thể tích không khí vừa đủ cần dùng ở đktc là (biết O2 chiếm 20% thể tích không khí)
A. 44,8 lít.
B. 56,0 lít.
C. 16,8 lít.
D. 84,0 lít.
Câu 13: Cho hỗn hợp gồm 5,6 lít CH4 và C2H4 phản ứng hoàn toàn với dung dịch brom 5% thấy có 400 gam dung dịch phản ứng. Phần trăm thể tích CH4 và C2H4 trong hỗn hợp ban đầu lần lượt là
A. 30% và 70%.
B. 40% và 60%.
C. 50% và 50%.
D. 25% và 75%.
Câu 14: Trong phòng thí nghiệm, một lượng nhỏ etilen được điều chế
A. từ khí cracking dầu mỏ
B. từ ancol etylic
C. từ khí etan C2H6
D. từ phản ứng của cacbon với hidro
Câu 15: Etilen có các tính chất hóa học sau:
A. Tham gia phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc tí và phản ứng cháy.
B. Chỉ tham gia phản ứng thế và phản ứng với dung dịch thuốc tím.
C. Chỉ tham gia phản ứng cháy.
D. Chỉ tham gia phản ứng cộng, phản ứng trùng hợp, không tham gia phản ứng cháy.
Bài viết trên đây đã cung cấp đầy đủ thông tin về định nghĩa, công thức cấu tạo, tính chất, cách điều chế và ứng dụng của etilen. Hi vọng những thông tin này sẽ giúp bạn có thêm những kiến thức bổ ích và ứng dụng chúng trong học tập cũng như thực tiễn.
Link nội dung: https://blog24hvn.com/cong-thuc-cau-tao-cua-etilen-a49188.html