
Cacbon Là Gì? Tính Chất Vật Lý, Hóa Học & Ứng Dụng Của Cacbon
1. Cacbon là gì?
Cacbon là nguyên tố phổ biến thứ 4 trong vũ trụ về mặt tổng khối lượng sau hidro, heli, và oxy. Cacbon có rất nhiều trong Mặt Trời, các vì sao, sao chổi và trong bầu khí quyển của phần lớn các hành tinh.
Cacbon là một loại nguyên tố hóa học nằm trong bảng tuần hoàn được ký hiệu là C với số nguyên tử bằng 6, nguyên tử khối bằng 12. Là một nguyên tố phi kim có hóa trị 4 phổ biến, cacbon có nhiều dạng thù hình khác nhau, phổ biến nhất là 4 dạng thù hình gồm cacbon vô định hình, kim cương, graphit và Q-carbon.
Khi nguyên tử cacbon liên kết với oxy tạo ra cacbon điôxit (CO2). CO2 là một nguyên liệu rất thiết yếu đối với sự sinh trưởng của thực vật. Khi cacbon liên kết với hidro, nó tạo ra một loạt các hợp chất hữu cơ gọi là các hidrocacbon đóng vai trò rất quan trọng đối với công nghiệp và trong dạng của các nhiên liệu hóa thạch. Khi cacbon liên kết với cả oxy và hidro có thể tạo ra rất nhiều nhóm các hợp chất khác bao gồm các axit béo - một chất hữu cơ rất cần thiết cho sự sống và este - tạo ra hương vị của nhiều loại hoa quả.

2. Vị trí và cấu hình electron nguyên tử
Trong bảng tuần hoàn, cacbon là nguyên tố có vị trí nằm ở ô thứ 6, nhóm IVA, chu kì 2 .
Cấu hình electron của cacbon có dạng là 1s22s22p2.
Các số oxi hóa của cacbon là -4, 0, +2 và +4.
Tham khảo ngay bộ tài liệu ôn tập kiến thức và tổng hợp phương pháp giải mọi dạng bài tập trong đề thi Hóa THPT Quốc gia

3. Tính chất vật lí
Nguyên tố cacbon tồn tại ở dưới dạng như là hình kim cương, than chì, fullerene,...
Cacbon tồn tại ở các cấu trúc khác nhau như trong tinh thể kim cương (a), tinh thể than chì (b) và fuleren (c) dưới đây:
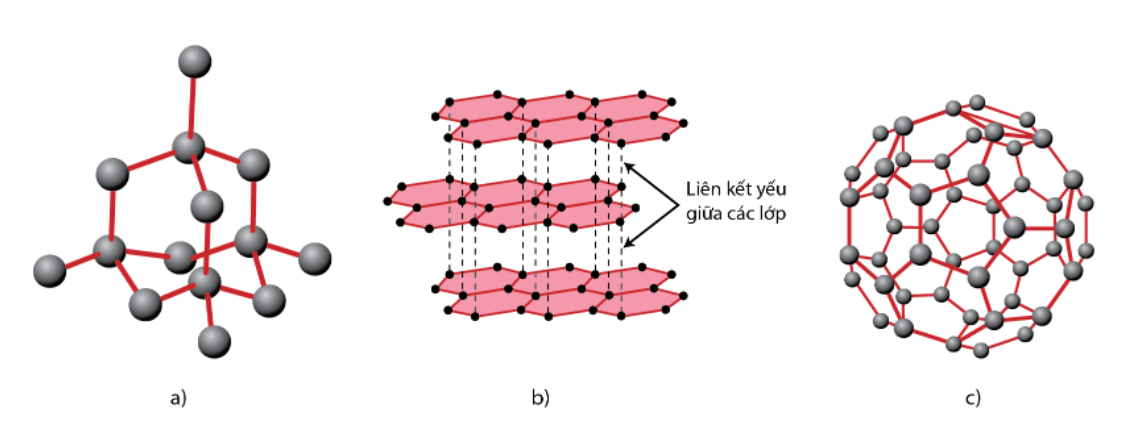
3.1. Kim cương
Là dạng tinh thể trong suốt, không có màu, không có khả năng dẫn điện, dẫn nhiệt kém.
Có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất tồn tại trên Trái đất.
3.2. Than chì
Là chất tinh thể có màu xám đen.
Tinh thể than chì mềm do có cấu trúc lớp.
3.3. Fuleren
Fuleren gồm các phân tử như C60, C70,... Phân tử C60 có cấu trúc hình cầu rỗng với 32 mặt, trong đó 60 đỉnh là 60 nguyên tử cacbon,…
3.4. Cacbon vô định hình
Các loại than điều chế nhân tạo như than gỗ, than muội, than xương,... được gọi chung là cacbon vô định hình. Chúng có cấu tạo xốp nên có khả năng hấp phụ mạnh các chất khí và chất tan trong dung dịch.
Cấu trúc tinh thể, tính chất vật lý của kim cương, than chì và cacbon vô định hình được trình bày ở bảng dưới đây:
Dạng thù hình
Cấu trúc tinh thể
Tính chất vật lý
Ứng dụng
Kim cương
Tứ diện đều
Trong suốt, không màu, không có khả năng dẫn điện, dẫn nhiệt kém.
Làm đồ trang sức, mũi khoan hoặc dao cắt thủy tinh,...
Than chì
Có cấu trúc lớp và các lớp liên kết yếu với nhau.
Có màu xám đen, khả năng dẫn điện tốt, mềm, cấu trúc các lớp dễ tách nhau.
Làm điện cực, chế tạo chất bôi trơn, làm nồi nấu chảy các hợp kim chịu nhiệt hay bút chì đen.
Cacbon vô định hình
Cấu trúc xốp
Khả năng hấp phụ mạnh.
Than cốc được ứng dụng làm chất khử trong công nghiệp luyện kim. Than hoạt tính được sử dụng trong mặt nạ phòng độc chuyên dụng. Than muội sử dụng để làm chất độn cao su, sản xuất xi đánh giày hoặc mực in,…
4. Tính chất hóa học
Cacbon vừa có tính oxy hóa vừa có tính khử.
4.1. Cacbon là chất khử
4.1.1. Tác dụng với các phi kim
Cacbon cháy được trong không khí. Phản ứng này tỏa nhiều nhiệt, tạo ra CO2 và một ít khí CO:
C0 + O2  +4CO2
+4CO2
+4CO2 + C0  2 +2CO
2 +2CO
4.1.2. Tác dụng với oxit kim loại
Cacbon có khả năng khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
Ví dụ:
CuO + C  Cu + CO
Cu + CO
Fe2O3 + 3C 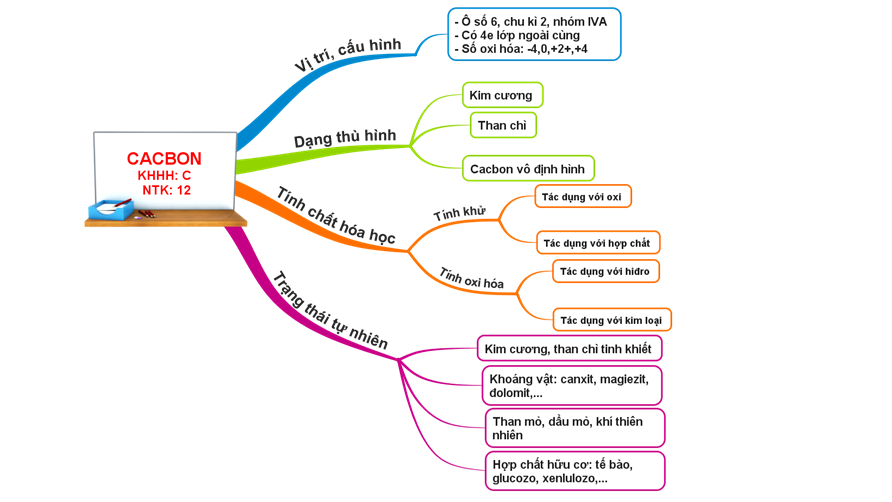 2Fe + 3CO
2Fe + 3CO
4.1.3. Tác dụng với CaO và Al2O3
CaO + 3C → CaC2 + CO (phản ứng trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (20000C)
4.1.4. Tác dụng với các chất oxi hóa mạnh
Thường gặp là H2SO4 đặc, HNO3, K2Cr2O7, KNO3, KClO3,… Trong các phản ứng này, C bị oxi hóa lên hóa trị mức cao nhất +4 (CO2).
C + 2 H2SO4 đặc CO2 + 2 SO2↑ + 2 H2O
C + 4 HNO3 đặc CO2 + 4 NO2↑ + 2 H2O
C + 4 KNO3 2 K2O + CO2 ↑ + 4 NO2
4.1.5. Tác dụng với hơi nước (khi nhiệt độ cao)
C + H2O CO + H2↑
C + 2 H2O → CO2 + 2 H2↑
4.2. Cacbon là chất oxi hóa
4.2.1. Tác dụng với H2
C + 2 H2 CH4
4.2.2. Tác dụng với kim loại - muối cacbua
4 Al + 3 C Al4C3
5. Trạng thái tự nhiên
Trong thiên nhiên kim cương và than chì là cacbon tự do gần như tinh khiết.
- Cacbon được chứa trong các khoáng sản như calcit (đá vôi, đá hoa, đá phấn đều có chứa CaCO3), Đolomit (CaCO3, MgCO3), Magiezit (MgCO3).
- Cacbon là thành phần chính trong các mỏ than, khí tự nhiên, dầu mỏ, cơ thể sinh vật.
Nước ta có mỏ than antraxit lớn nằm ở Quảng Ninh. Một số mỏ than khác nhỏ hơn ở Thanh Hóa, Nghệ An, Quảng Nam,…
6. Điều chế và ứng dụng của cacbon
6.1 Điều chế cacbon
Điều chế kim cương nhân tạo bằng cách nung than chì ở nhiệt độ khoảng 2000oC, dưới áp suất 50 đến 100 nghìn atmotphe cùng chất xúc tác là sắt, niken hay crom.
Than chì nhân tạo được điều chế bằng cách cho than cốc vào lò điện và nung ở nhiệt độ từ 2500 đến 3000oC trong điều kiện môi trường không có không khí.
Than cốc được điều chế bằng phương pháp nung than mỡ ở khoảng 1000oC trong lò cốc trong điều kiện không có không khí.
Than mỏ được khai thác trực tiếp trong các vỉa than nằm ở các độ sâu khác nhau dưới lòng đất.
Than gỗ được tạo thành khi đốt gỗ trong điều kiện thiếu không khí.
Than muội được tạo thành trong điều kiện nhiệt phân metan (CH4) và có mặt chất xúc tác:
CH4 C + 2H2
6.2 Ứng dụng của cacbon
Kim cương được dùng làm bột mài, chế tạo mũi khoan, dao cắt thủy tinh hoặc làm đồ trang sức.
Than chì được dùng làm điện cực, chế tạo nồi để nấu chảy các hợp kim chịu nhiệt, chế tạo chất bôi trơn, làm ruột bút chì đen.
Trong luyện kim, than cốc được sử dụng làm chất khử , để luyện kim loại từ quặng.
Than gỗ được ứng dụng trong chế tạo thuốc nổ đen và thuốc pháo,…
Than hoạt tính có khả năng hấp phụ mạnh nên được dùng trong chế tạo mặt nạ phòng độc và trong công nghiệp hóa chất.
Than muội được sử dụng làm chất độn cao su, sản xuất mực in hoặc xi đánh giày,...
7. Một số bài tập trắc nghiệm về cacbon (có đáp án)
Câu 1: Kim cương và than chì là 2 dạng thù hình của cacbon là do:
A. Kim cương và than chì cùng có cấu tạo mạng tinh thể giống nhau
B. Kim cương và than chì có tính chất vật lý tương tự nhau
C. Chúng đều cấu tạo từ nguyên tố cacbon
D. Chúng có màu sắc giống nhau
→ Đáp án: C.
Giải thích: Kim cương và than chì đều do nguyên tố cacbon tạo nên.
Câu 2: Kim cương cứng nhất trong tự nhiên. Trong khi đó, than chì lại mềm đến mức có thể sử dụng để sản xuất lõi bút chì 6B dùng để kẻ mắt. Giải thích nào là hợp lý?
A. Kim cương có cấu trúc tinh thể nguyên tử dạng tứ diện đều còn than chì có cấu trúc lớp và có khoảng cách giữa các lớp khá lớn
B. Kim cương là cacbon nhân tạo có kiểu liên kết cộng hóa trị bền vững
C. Than chì có các electron tự do
D. Một nguyên nhân khác
→ Đáp án đúng là đáp án A.
Giải thích:
-
Sự sắp xếp của các nguyên tử carbon trong kim cương ở dạng tứ diện, có nghĩa rằng 1 nguyên tử carbon được liên kết với 4 nguyên tử cacbon khác, hình thành nên liên kết hóa trị mạnh mẽ. Sự sắp xếp tinh thể này giúp kim cương có độ bền và độ cứng lớn. Đòi hỏi một lực cực lớn để phá vỡ hoặc làm trầy xước kim cương, và chính cấu trúc này khiến kim cương trở thành một trong những vật liệu cứng nhất trong tự nhiên.
-
Than thì thì hoàn toàn ngược lại với cấu hình không gian hoàn toàn khác so với kim cương. Các nguyên tử cacbon xếp lại thành các lớp 2D, mỗi nguyên tử cacbon sẽ liên kết với ba nguyên tử cacbon khác tạo nên hình sáu cạnh trong một chuỗi dài vô hạn. Mặc dù liên kết nguyên tử trong mỗi lớp là liên kết cộng hóa trị khá mạnh (tương đương với kim cương) nhưng liên kết giữa các lớp với nhau lại là tương tác rất yếu Van der Waals. Kết quả của sự sắp xếp này là các lớp có thể trượt lên nhau do đó tách khỏi nhau một cách dễ dàng. Những liên kết yếu giữa nhiều lớp nguyên tử cacbon làm cho than chì được sử dụng phổ biến trong bút chì và có thể gọt dễ dàng.
Câu 3: Phương trình phản ứng nào dưới đây là sai?
A. 2 C + O2 → 2 CO
B. 3 C + 2 KClO3 → 3 CO2 + 2 KCl
C. CaO + 4 C → CaC2 + 2 CO
D. C + MgO → CO2 + Mg
→ Đáp án: D.
Giải thích: Khi cho C tác dụng với MgO sẽ thu được CO và Mg theo phản ứng sau:
C + MgO → CO + Mg (đk: nhiệt độ 2000oC)
Câu 4: Trong các phản ứng dưới đây, phản ứng nào thể hiện tính khử của cacbon?
A. 3C + 4Al → Al4C3
B. C + 2H2 → CH4
C. C + 2CuO → Cu + CO2
D. Không có phản ứng nào
→ Đáp án: C.
Giải thích: Co - 4e → C+4
Câu 5: Trong các phản ứng hóa học
A. Cacbon chỉ thể hiện tính khử
B. Cacbon chỉ thể hiện được tính oxi hóa
C. Cacbon không thể hiện được cả tính khử lẫn tính oxi hóa
D. Cacbon thể hiện cả tính khử và tính oxi hóa
→ Đáp án: D.
Giải thích: Trong các phản ứng hóa học cacbon thể hiện cả tính oxi hóa và tính khử.
Câu 6: Đốt 2,4 gam than đá (chứa 5% tạp chất) trong oxi dư, thu được V lit khí cacbonic (đktc). Giá trị của V là:
A. 4,48 lit
B. 4,256 lit
C. 0,224 lit
D. 4,71 lit
→ Đáp án đúng là đáp án B.
Giải thích:
C + O2 CO2
0,19 → 0,19
Số mol Than đá: nCaCO3 = 2.412x 0.95 = 0.19 (mol)
Vậy thể tích khí CO2 là: V = 0,19. 22,4 = 4,256 (lit)
Câu 7: Nhận định nào dưới đây là sai?
A. Cacbon monoxit là một chất khử mạnh và không tạo ra muối.
B. Ở nhiệt độ cao cacbon có thể khử được tất cả các oxit kim loại và làm giải phóng kim loại.
C. than gỗ được dùng để chế thuốc súng, thuốc pháo, chất hấp phụ.
D. than muội được dùng trong sản xuất mực in, làm chất độn cao su và xi đánh giày.
→ Đáp án: B
Giải thích: Ở nhiệt độ cao cacbon có thể khử được một số oxit kim loại như PbO, ZnO,... thành kim loại Pb, Zn,…
Câu 8: Phản ứng nào trong các phản ứng dưới đây thể hiện tính oxi hóa của cacbon?
A. C + O2 → CO2
B. C + 2 CuO → 2 Cu + CO2
C. 3 C + 4 Al → Al4C3
D. C + H2O → CO + H2
→ Đáp án đúng là đáp án C.
Giải thích: tính oxi hóa của Cacbon được thể hiện trong phản ứng: 3 C + 4 Al → Al4C3
Do Co + 4e → C-4
Câu 9: Đốt cháy hết m gam than (C) bằng V lít oxi thu được 2,24 lít hỗn hợp khí X gồm 2 khí. X có tỉ khối với oxi bằng 1,25. Các thể tích đo được (đktc). Giá trị của m là
A. 1,2 và 1,96.
B. 1,5 và 1,792.
C. 1,2 và 2,016.
D. 1,5 và 2,8.
→ Đáp án đúng là đáp án A.
Giải thích: C + O2 → CO (x mol) + CO2 (y mol)
x + y = 0,1 ⇒ nC = 0,1 ⇒ m = 1,2 gam
28x + 44y = 32. 1,25(x + y) ⇒ x = 0,025; y = 0,075 (mol)
Bảo toàn nguyên tố O:
nO2 = 0,0875 mol
Câu 10: Cacbon là chất vô định hình được điều chế từ than gỗ hay gáo dừa thì gọi là than hoạt tính. Tính chất nào của than hoạt tính giúp con người chế tạo ra mặt nạ phòng độc và các thiết bị lọc nước?
A. Than hoạt tính dễ cháy.
B. Than hoạt tính có thể hấp phụ mạnh.
C.Than hoạt tính có cấu trúc lớp.
D. Than hoạt tính có khả năng có thể hòa tan tốt trong nhiều loại dung môi.
→ Đáp án:B.
Giải thích: Than hoạt tính có khả năng hấp phụ cao, có thể hấp phụ được các chất khí và chất tan trong nước. Vì vậy chúng được sử dụng trong mặt nạ phòng độc và trong công nghiệp hóa chất.
Ngoài ra, các em có thể tham khảo tổng quan kiến thức về Cacbon qua sơ đồ tư duy dưới đây:
Trên đây là toàn bộ những thông tin cần thiết liên quan đến cacbon của chương trình hóa học. Đây là một phần kiến thức rất quan trọng trong chương trình ôn thi đại học và yêu cầu các em phải nắm thật vững. Chúc các em ôn tập tốt. Ngoài ra, em có thể truy cập vào trang web Vuihoc.vn để tham khảo thêm nhiều bài giảng hoặc liên hệ trung tâm hỗ trợ để được hướng dẫn chi tiết nhé!
Link nội dung: https://blog24hvn.com/trong-phan-ung-hoa-hoc-cacbon-a55585.html