Tổng quan
Vi rút viêm gan B (HBV) là một loại vi rút DNA sợi đôi thuộc họ Hepadnaviridae. Nhiễm HBV là một vấn đề sức khỏe cộng đồng toàn cầu. Người ta ước tính rằng có hơn 250 triệu người mang HBV trên thế giới, trong đó khoảng 600.000 người tử vong hàng năm vì bệnh gan liên quan đến HBV. Châu Á bao gồm hơn 40 quốc gia từ Tây Thái Bình Dương, Đông Nam Á và Đông Địa Trung Hải; Các khu vực này được báo cáo là có tỷ lệ nhiễm HBV mãn tính cao thứ nhất, thứ ba và thứ tư vào năm 2015, lần lượt chiếm khoảng 115, 39 và 21 triệu người nhiễm HBV. (1)
HBV có thể gây viêm gan tối cấp, viêm gan cấp và viêm gan mạn, tiến triển thành xơ gan, ung thư tế bào gan. Ở Việt Nam, HBV là một trong những nguyên nhân hàng đầu gây bệnh viêm gan mạn và ung thư gan. Kiểm soát tốt bệnh viêm gan siêu vi B sẽ giúp làm các biến chứng và tử vong liên quan đến bệnh gan. Vấn đề điều trị khó khăn, lâu dài, tốn kém và phải chấp nhận các tác dụng phụ của thuốc.
Tenofovir Alafenamide- TAF là một bước tiến bộ mới trong kiểm soát bệnh hiệu quả và ít tác dụng phụ trong điều trị lâu dài. Cuối năm 2016, Cơ quan Quản lý thuốc và thực phẩm Hoa Kỳ (FDA) đã công nhận Tenofovir alafenamide (TAF) là thuốc mới điều trị VGSV B mạn tính. TAF hiện nay là thuốc uống được chọn lựa đầu tay cho điều trị viêm gan B vì khả năng ức chế vi rút cao, không kháng thuốc, an toàn cho xương và thận, đặc biệt dùng an toàn cho người lớn tuổi, người có tiền sử bệnh xương và người có chức năng thận suy yếu.
Dược động học của TAF
TAF và TDF đều là tiền chất của tenofovir khi vào tế bào gan chuyển hóa thành một chất có hoạt tính nội bào (tenofovir diphotphat TFV-DP). TDF sau khi uống, một phần lớn đã bị thủy phân thành dạng TFV ngay trong huyết tương khi chưa vào cơ quan đích. Trong khi TAF ổn định hơn trong huyết tương so với TDF, vào đến cơ quan đích, tế bào gan mới được thủy phân thành TFV. Sau đó TFV được phosphoryl hóa thành dạng hoạt động TFV- DP, tác động ức chế lên HBV DNA.
Liều TAF 25 mg trong khi liều của TDF 300mg do TAF có thời gian bán hủy dài và tính ổn định trong huyết tương tốt hơn TDF. Thuốc sau khi uống được đi thẳng vào tế bào gan và chuyển thành dạng hoạt động TFV-DP, tiếp xúc toàn thân của TAF thấp hơn 90% so với TDF do đó thuốc ít gây tác dụng phụ toàn thân như ảnh hưởng chức năng thận, giảm mật độ xương. Liều TAF 25mg/ ngày uống sau ăn sáng. Thuốc không cần giảm liều đối với bệnh nhân suy gan, suy thận với CrCl >15ml/phút hoặc chạy thận nhân tạo
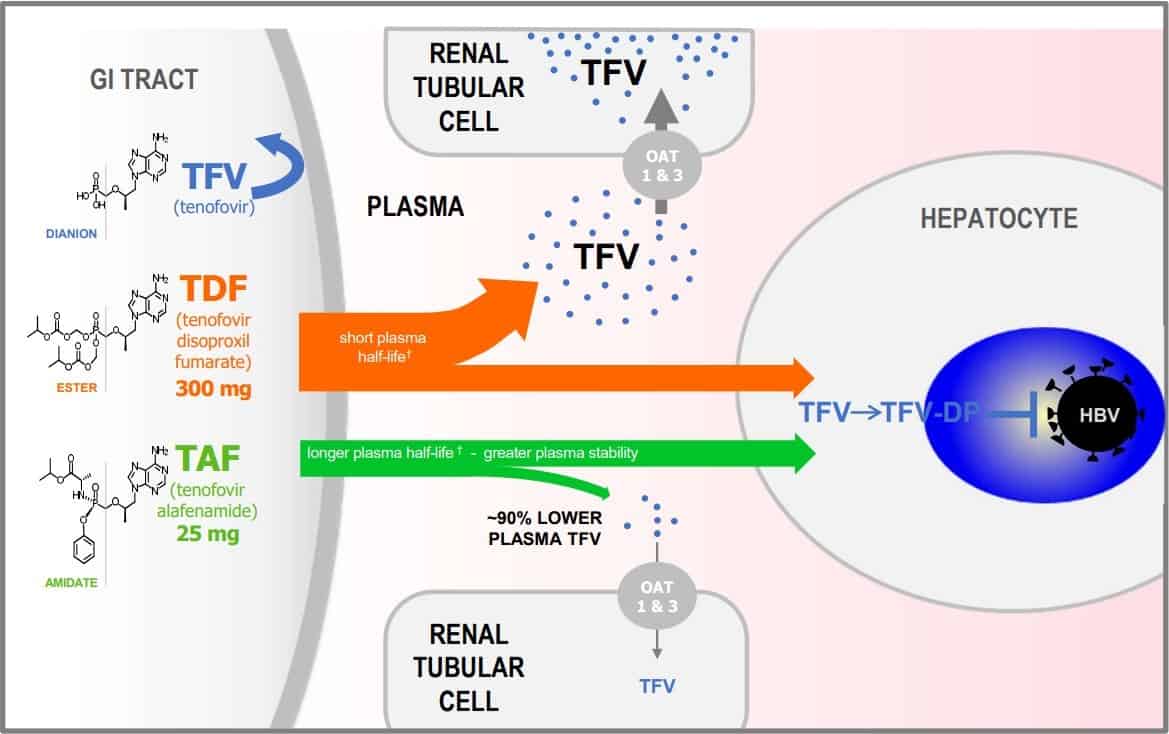
Hình 1: Dược động học của thuốc TAF
Hiệu quả điều trị của TAF
So sánh với TDF
Thuốc kháng vi rút TAF có cơ chế hoạt động tương tự như TDF: một nucleotide ức chế men sao chép ngược. Kết quả của các nghiên cứu thử nghiệm pha III cho thấy TAF không thua kém TDF trong việc ức chế tải lượng vi rút HBV trong quá trình điều trị.
Hai thử nghiệm đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng pha III đánh giá hiệu quả và độ an toàn của TAF 25 mg so với TDF 300 mg trong điều trị viêm gan B mạn ở nhóm HBeAg âm tính (nghiên cứu 108) (2) và HBeAg dương tính (nghiên cứu 110) (3). Tổng số 1.298 bệnh nhân nhiễm HBV chưa từng điều trị và đã từng điều trị được chọn ngẫu nhiên 2: 1 (TAF:TDF). Tiêu chí đủ điều kiện chọn bệnh bao gồm mức ALT> 60 U/L đối với nam và > 38 U/L đối với nữ (và không quá 10 lần giới hạn trên của mức bình thường) và độ thanh thải creatinin ≥ 50 mL/phút. Tiêu chuẩn loại trừ gồm giảm tiểu cầu, thiếu máu, giảm albumin máu, tăng bilirubin trong máu, xơ gan mất bù và/ hoặc ung thư biểu mô tế bào gan. Tiêu chí đánh giá chính cho cả hai nghiên cứu là tỷ lệ đạt được HBV DNA <29 IU / mL ở tuần 48 sau điều trị.
Các tiêu chí phụ bao gồm đáp ứng sinh hóa và các thay đổi huyết thanh học khác liên quan đến HBV, an toàn cho xương và thận. Sau đó, tiếp tục so sánh hiệu quả điều trị ở tuần 96 và tuần 144.
Bảng 1: Hiệu quả của TAF so với TDF ở 48, 96 và 144 tuần ở bệnh nhân HBV mạn tính, HBeAg âm tính (4),(2),(5)
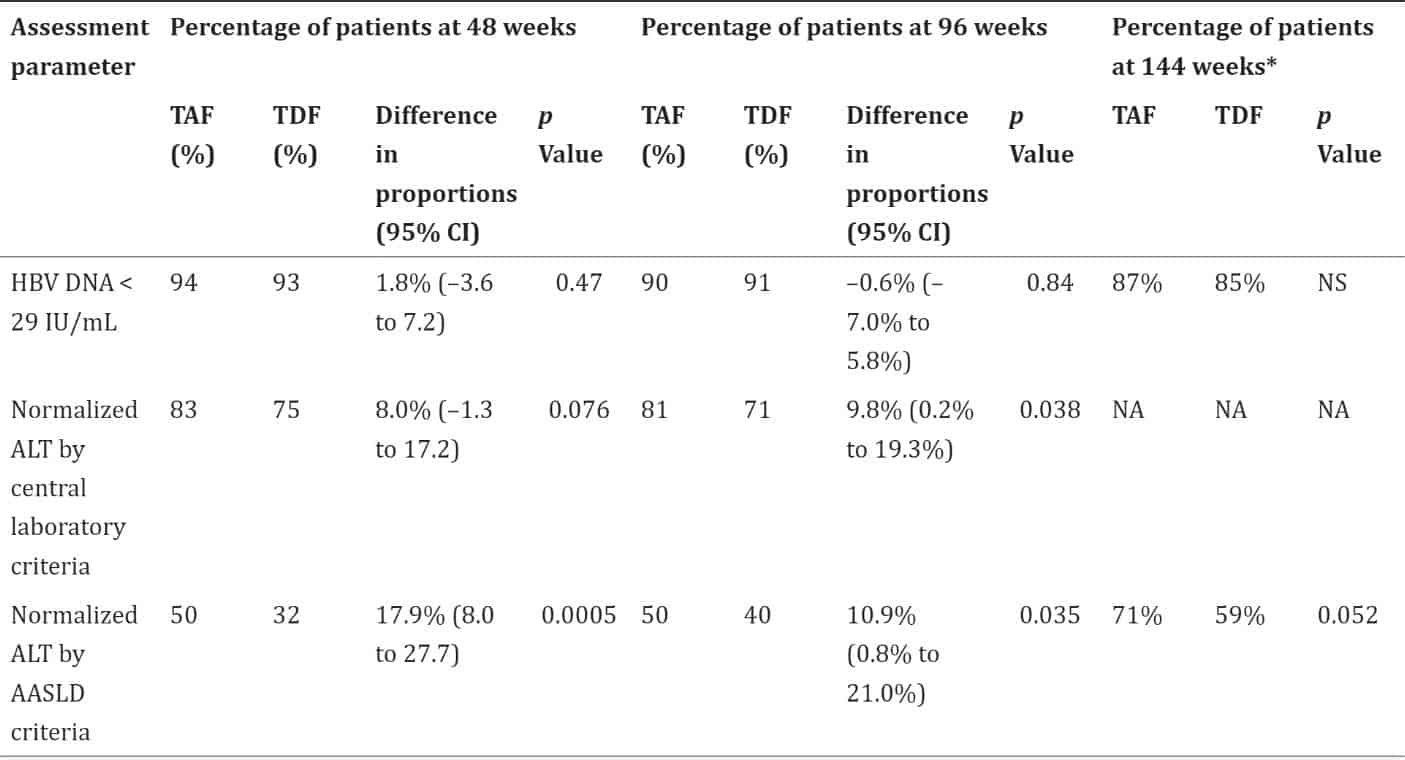
Bảng 2: Hiệu quả của TAF so với TDF ở 48, 96 và 144 tuần ở bệnh nhân HBV mạn tính, HBeAg dương tính (4),(2), (5)
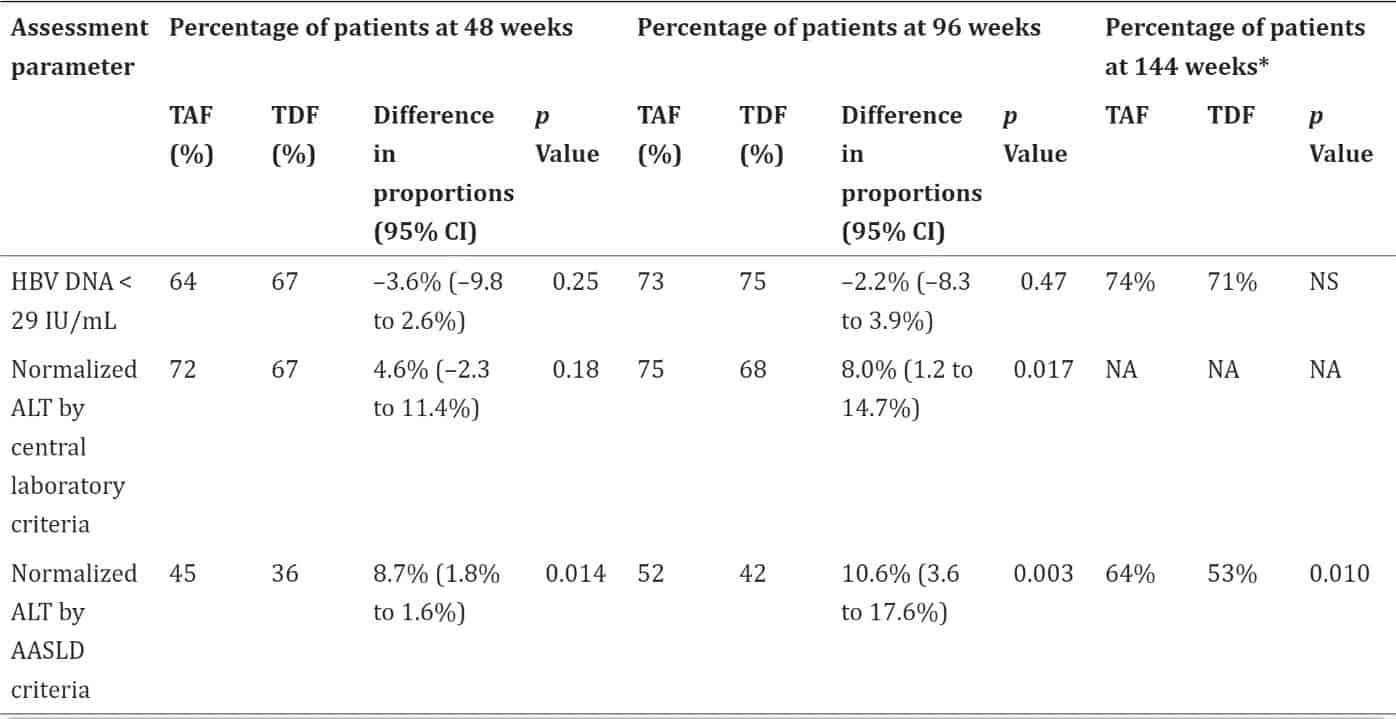
Kết quả cho thấy việc điều trị bằng TAF không thua kém TDF ở 48, 96 và 144 tuần ở cả bệnh nhân nhiễm HBV mạn tính có HBeAg âm tính và HBeAg dương tính. Mức độ bình thường của ALT được phát hiện là cao đáng kể ở những bệnh nhân được điều trị bằng TAF so với TDF ở tuần 96, theo tiêu chí phòng thí nghiệm trung tâm và tiêu chí AASLD, và ở tuần 144 theo tiêu chí AASLD trong cả hai nghiên cứu. Không có sự khác biệt đáng kể giữa hai nhóm về chuyển đổi hoặc mất huyết thanh HBeAg hoặc HBsAg, ở các tuần 48, 96 và 144 trong cả hai nghiên cứu. b. So sánh với các thuốc kháng vi rút khác Một nghiên cứu tổng hợp từ 42 nghiên cứu thử nghiệm lâm sàng ngẫu nhiên có đối chứng. Các tiêu chí đánh giá là đáp ứng vi rút học (VR), bình thường hóa alanin aminotransferase (chỉ tiêu ALT), mất HBeAg, chuyển đổi huyết thanh HBeAg và mất HBsAg (6).
Tổng hợp các nghiên cứu từ năm 1998- 2017, so sánh các thuốc đang điều trị viêm gan siêu vi B mạn như Lamivudine, Adefovir, Telbivudine, Tenofovir TDF, TAF, PEG-INF, cả phương pháp phối hợp thuốc. Kết quả cho thấy, trong nhóm HBeAg dương tính TDF và TAF đạt mức đáp ứng vi rút tốt nhất (OR so với adefovir = 14,29, KTC 95% 7,69-25 và 12,5, KTC 95% 4,35-33,33). TAF là tốt nhất để đạt được chỉ số ALT (OR so với giả dược = 12,5, KTC 95% 4,55-33,33), cũng như tiêu chí mất HBeAg và chuyển đổi huyết thanh (OR so với kết hợp entecavir / TDF = 3,03, KTC 95% 1,04-8,84 và 3,33, KTC 95% 1,16-10). Trong nhóm HBeAg âm tính, TDF và TAF là tốt nhất cho đáp ứng vi rút VR (OR so với adefovir = 9,79, KTC 95% 2,38-42,7 và 11,71, KTC 95% 1,03-150,48). Telbivudine và TAF là tốt nhất cho chỉ tiêu bình thường hóa men gan ALT. Kết quả của nghiên cứu tổng hợp trên phù hợp với các hướng dẫn lâm sàng hiện tại và các đánh giá bằng chứng khác. Đối với cả quần thể HBeAg dương tính và HBeAg âm tính, TDF và TAF là những tác nhân hiệu quả nhất để ức chế vi rút, và TAF có hiệu lực trên tất cả các tiêu chí đánh giá (6).
Chuyển từ thuốc kháng vi rút khác sang TAF
Một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm, pha 3, thực hiện trên 42 địa điểm tại 8 quốc gia bao gồm Mỹ, Anh, Canada, Hồng Kông, Đài Loan, Hàn Quốc, Ý và Tây Ban Nha trên những bệnh nhân nhiễm HBV mạn đã ức chế vi rút và đang điều trị lâu dài với TDF. Chia thành 2 nhóm, 1 nhóm tiếp tục điều trị với TDF 300mg/ ngày, 1 nhóm được chuyển sang điều trị với TAF 25 mg/ngày và thời gian điều trị mù đôi là 48 tuần. Tiêu chí đánh giá chính là mất kiểm soát vi rút, HBV DNA tăng> 20UI/ml và các tiêu chí an toàn chính là sự thay đổi mật độ khoáng xương hông và xương sống, độ thanh thải creatinin ước tính bằng Cockcroft-Gault. Kết quả hình 2 cho thấy, hiểu quả kiểm soát đáp ứng vi rút ở 2 nhóm là tương đương nhau, khoảng <1% bệnh nhân bị mất kiểm soát đáp ứng vi rút sau 48 tuần điều trị.
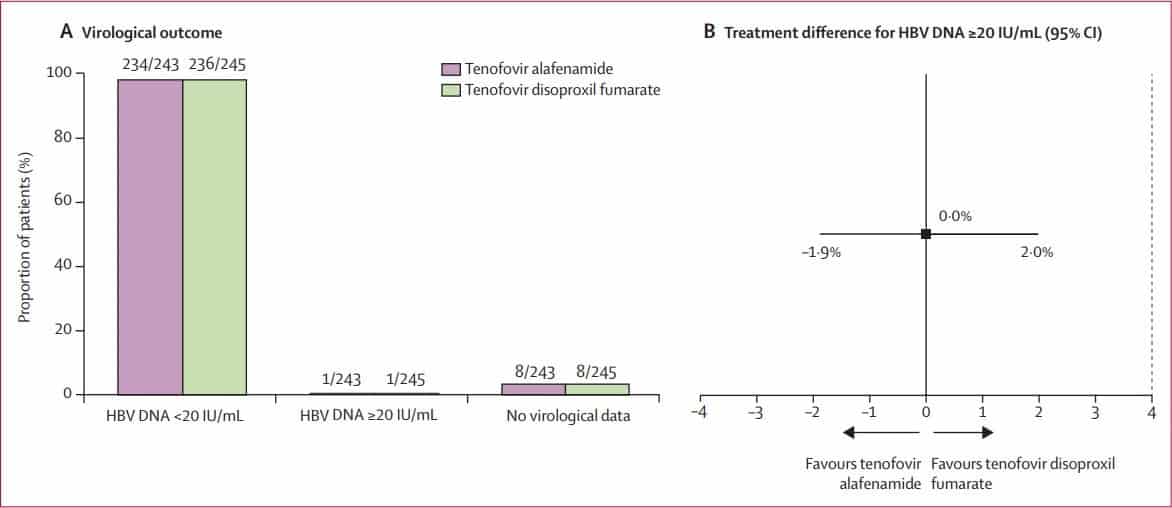
Hình 2: Kết quả đáp ứng vi rút ở tuần thứ 48 ở nhóm tiếp tục điều trị TDF và nhóm chuyển sang TAF (7)
Về tiêu chí an toàn là sự thay đổi mật độ khoáng xương hông và xương sống cho thấy nhóm bệnh nhân được sử dụng TAF, cải thiện mật độ xương so với nhóm tiếp tục sử dụng TDF.(hình 3)
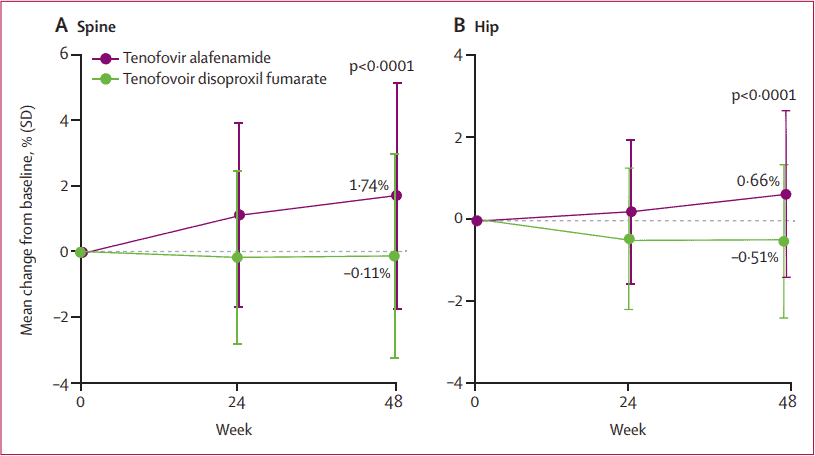
Hình 3: Cải thiện mật độ xương ở xương cột sống và xương hông ở 2 nhóm TAF và TDF sau 48 tuần điều trị
Về tiêu chí an toàn trên thận, kết quả cho thấy có sự cải thiện mức độ thanh thải creatinin ở nhóm được chuyển sang dùng TAF, còn nhóm tiếp tục dùng TDF thì mức độ thanh thải creatinin có xu hướng tiếp tục giảm.
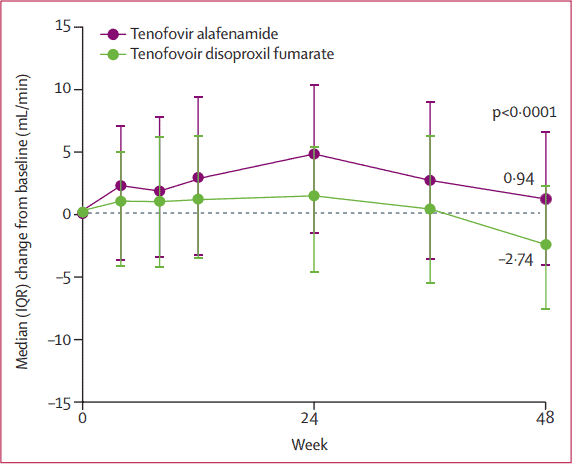
Hình 4: Thay đổi độ thanh thải creatinin ở 2 nhóm sau 48 tuần điều trị
Nghiên cứu trên kết luận rằng ở những bệnh nhân nhiễm HBV mạn đã ức chế vi rút và đang điều trị lâu dài với TDF, chuyển sang TAF an toàn và hiệu quả, đồng thời các bất thường về thận, xương liên quan đến TDF được cải thiện rõ khi chuyển sang TAF (7).
Một nghiên cứu khác trên 159 bệnh nhân viêm gan B mạn được điều trị bằng Entecavir sau đó chuyển sang TAF, mức độ giảm nồng độ HBsAg trong huyết thanh cao hơn khi chuyển sang TAF so với tiếp tục dùng Entecavir ở bệnh nhân không xơ gan và có HBV kiểu gen B (8).
Kết quả với TAF ở bệnh nhân xơ gan mất bù và người ghép gan
Mặc dù chưa có nghiên cứu nào so sánh hiệu quả và độ an toàn của TDF so với TAF ở bệnh nhân nhiễm HBV bị xơ gan mất bù, nhưng hướng dẫn của AASLD khuyến nghị TAF như một giải pháp thay thế an toàn cho TDF ở những bệnh nhân xơ gan mất bù có rối loạn chức năng thận và / hoặc bệnh xương tiềm ẩn (9). Đối với những người ghép gan nhiễm HBV, trong một phân tích hồi cứu gần đây (bao gồm 72% người Châu Á Thái Bình Dương), việc sử dụng TAF có liên quan đến việc suy giảm chức năng thận ít hơn khi so sánh với các thuốc kháng vi rút khác (10). Trong một nghiên cứu dựa trên cơ sở đăng ký khác được thực hiện ở châu Á, việc chuyển từ điều trị dự phòng bằng TDF sang TAF ở những người ghép gan nhiễm HBV có liên quan đến việc tăng mức bình thường hóa nồng độ ALT và cải thiện chức năng thận.
Tính dung nạp và an toàn của TAF
Thuốc TAF được dung nạp tốt trong các nghiên cứu. Các tác dụng ngoại ý thường gặp như nhiễm trùng đường hô hấp trên, nhức đầu và viêm mũi họng.
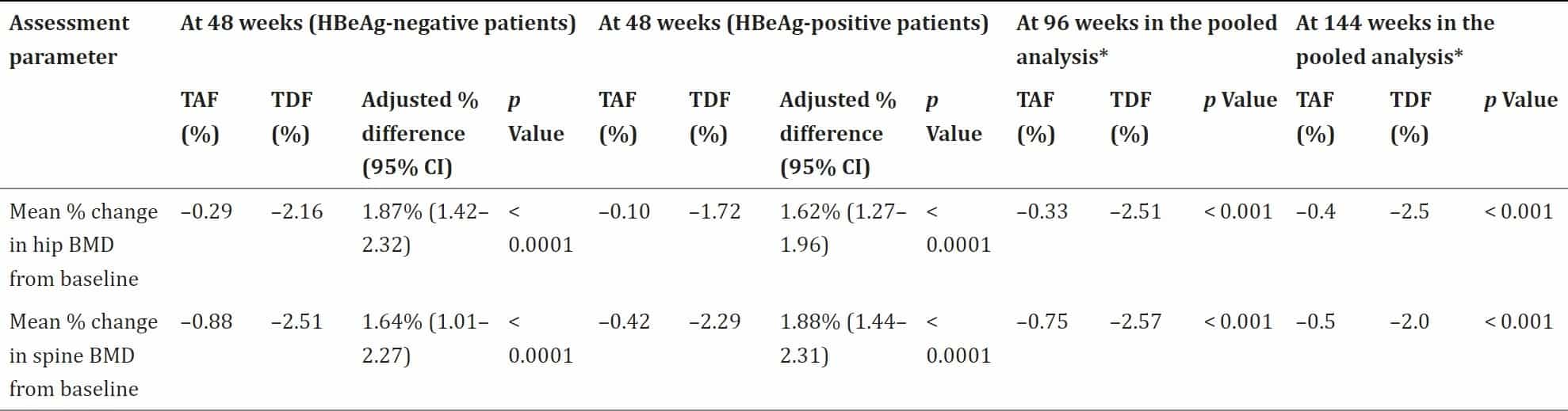
Các thuốc TDF và ETV đều được chuyển hóa qua thận và phải chỉnh liều khi GFR < 50ml/phút/1.73m2 An toàn cho xương (lên đến 144 tuần). Sự suy giảm mật độ khoáng xương (BMD) ở xương hông và cột sống thấp đáng kể với TAF so với TDF ở 48, 96 và 144 tuần trong cả hai nghiên cứu (Bảng
3). Hơn nữa, mức độ khác biệt về sự giảm BMD ở hông giữa nhóm TAF và TDF lớn hơn đáng kể ở 96 tuần so với sự khác biệt quan sát được ở 48 tuần (p<0,001).
Bảng 3: Thay đổi BMD hông và cột sống so với ban đầu với TAF vs. TDF ở 48, 96 và 144 tuần ở bệnh nhân HBV mạn tính HBeAg âm tính và HBeAg dương tính
An toàn cho thận (lên đến 144 tuần). Giảm eGFR nhỏ hơn đáng kể trong nhóm TAF so với nhóm TDF được ghi nhận ở tuần 48, trong cả hai nghiên cứu (thay đổi trung bình trong GFR ước tính: nghiên cứu 108: - 1,8 mL/phút so với - 4,8 mL/phút; p = 0,004; nghiên cứu 110: - 0,6 mL/phút so với - 5,4 mL / phút; p <0,0001) (2). An toàn cho thận với TAF được duy trì ở tuần 96 (thay đổi eGFR so với ban đầu trong phân tích gộp: - 1,2 mL / phút so với - 4,8 mL / phút tương ứng ở nhóm TAF so với TDF; p <0,001) (3), và tuần 144 (thay đổi eGFR so với ban đầu trong phân tích gộp ở tuần 144 trong giai đoạn mở rộng mù đôi:- 1,2 mL / phút so với - 6,0 mL / phút tương ứng ở nhóm TAF so với TDF; p <0,001) (11).
Nghiên cứu trên những bệnh nhân viêm gan B mạn bị bệnh thận mạn, bao gồm cả suy thận giai đoạn cuối có lọc máu cho thấy tình trạng ức chế vi rút được duy trì tốt và sự an toàn ở xương và thận ổn định hoặc được cải thiện sau khi chuyển sang TAF ở tuần thứ 48 (12).
Tính đề kháng của TAF
Trong phân tích tổng hợp của các nghiên cứu 108 và nghiên cứu 110 tại 96 tuần, nhìn chung, không có chủng phân lập kháng thuốc nào được phát hiện trong nhóm TAF (2), (3). Trong phân tích kiểu hình ở tuần thứ 144 của pha mở rộng mù đôi ở 49 bệnh nhân, cho thấy không có chủng nào kháng TAF (5). Cho đến nay, chưa có trường hợp kháng thuốc TAF nào được báo cáo ở những đối tượng chưa từng điều trị hoặc đã được điều trị.
Chỉ định của TAF
Bảng 4: Bệnh nhân nhiễm HBV, thích hợp chỉ định để điều trị bằng TAF (11)
Bệnh nhân nhiễm HBV Chỉ định TAF Có nguy cơ mắc bệnh về xương vàthận
Tuổi ≥ 50 tuổiBệnh nhân chạy thận nhân tạo
Bệnh nhân có eGFR < 60mL/phút/1,73m2 (bệnh thận mạn giai đoạn 3-5)
Phụ nữ sau mãn kinh
Bệnh nhân béo phì (BMI> 30 kg / m2)
Với các bệnh đi kèm có nguy cơ bệnh thận Tăng huyết ápĐái tháo đường týp 1 và týp 2 Bệnh tim mạch
Hút thuốc
Bệnh nhân có nguy cơ thiếu vitamin D Tiền sử gia đình mắc bệnh thận
Lupus
Bệnh đa u tủy
Với các bệnh đi kèm có nguy cơ bệnh xương Tiền sử gãy xương Cường cận giáp Bệnh hen suyễnCác vấn đề về dinh dưỡng hoặc tiêu hóa (ví dụ như bệnh Crohn hoặc bệnh celiac)
Rối loạn huyết học hoặc bệnh ác tính
Giảm sinh dục (ví dụ: hội chứng Turner / hội chứng Klinefelter, vô kinh, v.v.)
Rối loạn nội tiết (ví dụ như hội chứng Cushing)
Bất động
Dùng thuốc gây nhiễm độc thận Thuốc chống đông máu, NSAID, chất ức chế calcineurin Dùng thuốc gây nhiễm độc xương Steroid, hormone tuyến giáp (l-thyroxine), một số hormone steroid (medroxyprogesterone acetate, chất chủ vận hormone giải phóng hoàng thể), chất ức chế aromatase, một số thuốc chống loạn thần / chống co giật / thuốc chống động kinh, lithium, methotrexate, thuốc kháng axit vàPPI
Với BN xơ gan, hoặc ghép gan Điều trị bằng ETV và lập kế hoạch chuyển đổi do các vấn đề đề khángthuốc
Kết luận
Nhiễm HBV mãn tính có tỷ lệ lưu hành từ trung bình đến cao với tỷ lệ mắc và tử vong cao. Tenofovir alafenamide là một thuốc kháng vi rút có khả năng chống lại sự đề kháng của HBV và đã được chứng minh về hiệu quả và độ an toàn lâu dài ở bệnh nhân HBV mạn tính HBeAg dương tính và HBeAg âm tính. TAF có thể là một lựa chọn hiệu quả cho những bệnh nhân kháng ETV và là một lựa chọn an toàn hơn TDF. TAF có hiệu quả tốt nhất trên tất cả các tiêu chí. Bệnh nhân viêm gan B mạn điều trị lâu dài với TDF, chuyển sang điều trị với TAF, các bất thường về xương thận liên quan đến TDF được cải thiện.
CÁC CHỮ VIẾT TẮT
- AASLD American Association for the Study of Liver Diseases (Hiệp hội Nghiên cứu Bệnh gan Hoa Kỳ)
- ALT alanine aminotransferase ETV Entecavir
- CI confidence interval
- DNA deoxy ribonucleic acid HBeAg hepatitis B e-antigen HBV hepatitis B vi rút
- NS non-significant NA not available
- PPI Proton pump inhibitor (thuốc ức chế bơm proton) TAF tenofovir alafenamide
- TDF tenofovir disoproxil fumarate VGSV B Viêm gan siêu vi B
TÀI LIỆU THAM KHẢO
- Global Hepatitis Report 2017. Geneva: World Health Organization. 2017. https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/. Accessed 29 Jul 2018. 2017.
- Buti M, Gane E, Seto WK, Chan HL, Chuang WL, Stepanova T, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg- negative chronic hepatitis B vi rút infection: a randomised, double-blind, phase 3, non-inferiority trial. The lancet Gastroenterology & hepatology. 2016;1(3):196-206.
- Chan HL, Fung S, Seto WK, Chuang WL, Chen CY, Kim HJ, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of HBeAg-positive chronic hepatitis B vi rút infection: a randomised, double-blind, phase 3, non-inferiority trial. The lancet Gastroenterology & hepatology. 2016;1(3):185-95.
- Agarwal K, Brunetto M, Seto WK, Lim YS, Fung S, Marcellin P, et al. 96 weeks treatment of tenofovir alafenamide vs. tenofovir disoproxil fumarate for hepatitis B vi rút infection. Journal of hepatology. 2018;68(4):672-81.
- Chan HLY, Lim Y-S, Seto WKW, Agarwal K, Brunetto MR, Janssen HL, et al., editors. Three year efficacy and safety of tenofovir alafenamide (TAF) compared to tenofovir disoproxil fumarate (TDF) in Hbeag-negative and Hbeag-positive patients with chronic hepatitis B. American Association for the Study of Liver Diseases (AASLD): The Liver Meeting 2018; 2018: John Wiley & Sons, Inc.
- Wong WWL, Pechivanoglou P, Wong J, Bielecki JM, Haines A, Erman A, et al. Antiviral treatment for treatment-naive chronic hepatitis B: systematic review and network meta-analysis of randomized controlled trials. Syst Rev. 2019;8(1):207.
- Lampertico P, Buti M, Fung S, Ahn SH, Chuang WL, Tak WY, et al. Switching from tenofovir disoproxil fumarate to tenofovir alafenamide in virologically suppressed patients with chronic hepatitis B: a randomised, double-blind, phase 3, multicentre non-inferiority study. The lancet Gastroenterology & hepatology. 2020;5(5):441-53.
- Uchida Y, Nakao M, Tsuji S, Uemura H, Kouyama JI, Naiki K, et al. Significance of switching of the nucleos(t)ide analog used to treat Japanese patients with chronic hepatitis B vi rút infection from entecavir to tenofovir alafenamide fumarate. Journal of medical virology. 2020;92(3):329-38.
- Terrault NA, Lok ASF, McMahon BJ, Chang K-M, Hwang JP, Jonas MM, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99.
- Saab S, Song D, Challita YP, Xiwen Zhou T, Saab EG, Viramontes MR, et al. Long-term outcomes with oral therapy in liver transplant recipients with hepatitis B. Clinical transplantation. 2019;33(12):e13740.
- Charlton MR, Alam A, Shukla A, Dashtseren B, Lesmana CRA, Duger D, et al. An expert review on the use of tenofovir alafenamide for the treatment of chronic hepatitis B vi rút infection in Asia. J Gastroenterol. 2020;55(9):811-23.
- Janssen H, Lampertico P, Chen C-Y, Heo J, Fournier C, Ahn SH, et al. Safety and efficacy of switching to tenofovir alafenamide (TAF) in virally suppressed chronic hepatitis B (CHB) patients with renal impairment: week 48 results from a phase 2 open label study. Journal of hepatology. 2020;73:S868-S9.


