Thuốc KADCYLA là thuốc gì ? Dưới đây là nội dung tờ hướng dẫn sử dụng gốc của Thuốc KADCYLA (Thông tin bao gồm liều dùng, cách dùng, chỉ định, chống chỉ định, thận trọng, dược lý…)
Hoạt chất : Trastuzumab
Phân loại: Thuốc chống ung thư.
Nhóm pháp lý: Thuốc kê đơn ETC - (Ethical drugs, prescription drugs, Prescription only medicine)
Mã ATC (Anatomical Therapeutic Chemical): L01XC03.
Brand name: KADCYLA
Hãng sản xuất : Roche Diagnostics GmbH - Germany
Dạng thuốc và hàm lượng
Bột pha dịch truyền: lọ 100mg, lọ 160mg.
Mỗi lọ: Trastuzumab emtansine 100mg hoặc 160mg.
Thuốc tham khảo:
KADCYLA 160 mg Mỗi lọ bột pha dung dịch tiêm truyền tĩnh mạch có chứa: Trastuzumab …………………………. 160 mg Tá dược …………………………. vừa đủ (Xem mục 6.1)[VIDEO DƯỢC LÝ]
————————————————
► Kịch Bản: PharmogTeam
► Youtube: https://www.youtube.com/c/pharmog
► Facebook: https://www.facebook.com/pharmog/
► Group : Hội những người mê dược lý
► Instagram : https://www.instagram.com/pharmogvn/
► Website: pharmog.com
4.1. Chỉ định:
Ung thư vú
Ung thư vú di căn (MBC): Kadcyla, sử dụng đơn độc, được chỉ định điều trị cho các bệnh nhân dương tính với HER2, ung thư vú di căn hoặc ung thư vú tiến triển tại chỗ không phẫu thuật được, đã được điều trị trước đó bằng trastuzumab và một thuốc taxane.
4.2. Liều dùng - Cách dùng:
Cách dùng :
Hướng dẫn đặc biệt cho sử dụng, pha chế và xử lý
Cần sử dụng các kỹ thuật vô khuẩn thích hợp. Nên sử dụng các quy trình thích hợp cho pha chế các thuốc hóa trị liệu.
Thuốc sau khi được pha không chứa chất bảo quản và chỉ sử dụng một lần duy nhất. Loại bỏ phần thuốc không sử dụng.
Sử dụng một bơm tiêm vô trùng, bơm chậm 5 ml nước vô khuẩn dành để pha tiêm vào lọ 100mg trastuzumab emtansine hoặc 8 ml nước vô khuẩn dành để pha tiêm vào lọ chứa 160mg thuốc.
Xoáy nhẹ lọ cho đến khi thuốc được hòa tan hoàn toàn. KHÔNG ĐƯỢC LẮC LỌ!
Bảo quản trastuzumab emtansine sau khi pha ở 2-8ºC; loại bỏ phần trastuzumab emtansine không được sử dụng sau 24 giờ.
Trước khi sử dụng, dung dịch đã được pha cần phải được quan sát bằng mắt về sự có mặt của các hạt và sự đổi màu dung dịch. Dung dịch sau khi pha không nên có mặt các hạt có thể nhìn thấy và trong đến hơi đục. Dung dịch sau khi pha nên không màu đến nâu nhạt. Không sử dụng nếu dung dịch sau khi pha có các hạt có thể nhìn thấy, hoặc vẩn đục, hoặc bị đổi màu.
Hướng dẫn pha loãng:
Xác định thể tích dung dịch cần dùng dựa trên liều dùng 3,6 mg trastuzumab emtansine cho 1 kg thể trọng (xem mục lịch trình giảm liều): Thể tích (ml) = [Trọng lượng cơ thể (kg) x liều (mg/kg)] / [20 mg/ml (nồng độ dung dịch sau khi pha)]
Thể tích dung dịch thích hợp nên được lấy ra từ lọ và thêm vào túi dịch truyền chứa 250 ml dung dịch natri clorid 0,45% hoặc natri clorid 0,9%. Không nên sử dụng dung dịch dextrose (5%). Nếu sử dụng dung dịch natri clorid 0,45%, không cần lọc qua màng lọc 0,2 hoặc 0,22 micron polyethersulfone (PES). Nếu sử dụng dung dịch natri clorid 0,9% để truyền, cần lọc qua màng lọc 0,2 hoặc 0,22 micron polyethersulfone (PES). Khi dịch truyền đã được chuẩn bị, nên sử dụng ngay. Trong trường hợp chưa sử dụng ngay, dịch truyền cần được bảo quản trong vòng 24 h trong tủ lạnh ở nhiệt độ 2°C-8°C. Không để đông hoặc lắc dịch truyền trong quá trình bảo quản.
Liều dùng:
Để tránh nhầm lẫn phải kiểm tra nhãn thuốc để đảm bảo thuốc đang được pha chế và sử dụng là Kadcyla (trastuzumab emtansine) và không phải là trastuzumab.
Điều trị bằng Kadcyla chỉ nên thực hiện dưới sự giám sát của nhân viên y tế có kinh nghiệm trong điều trị bệnh nhân ung thư.
Bệnh nhân được điều trị với Kadcyla phải là các bệnh nhân có khối u dương tính với HER2, được định nghĩa là có điểm hóa mô miễn dịch (IHC) 3+ hoặc tỷ lệ ≥ 2,0 được xác định bằng kỹ thuật lai hóa tại chỗ với xét nghiệm đã được kiểm định.
Để cải thiện việc truy xuất nguồn gốc của thuốc, tên thương mại và số lô của thuốc đã được sử dụng cần được ghi rõ trong hồ sơ bệnh nhân.
Việc thay thế bằng bất cứ một loại thuốc sinh học nào khác cũng cần phải được sự đồng ý của bác sĩ kê đơn.
Kadcyla cần phải được hòa tan và pha loãng bởi nhân viên y tế và được sử dụng theo đường truyền tĩnh mạch (xem mục Hướng dẫn đặc biệt về Sử dụng, Thao tác và cách xử lý). Không dùng đường tiêm tĩnh mạch hoặc bơm tĩnh mạch.
Lịch dùng thuốc
Liều Kadcyla được khuyến cáo là 3,6 mg/kg theo đường truyền tĩnh mạch mỗi 3 tuần (liệu trình 21 ngày) cho đến khi bệnh tiến triển hoặc xảy ra độc tính không thể chấp nhận được.
Liều khởi đầu được truyền tĩnh mạch trong 90 phút. Nên theo dõi bệnh nhân trong suốt quá trình truyền và ít nhất 90 phút sau khi truyền liều đầu tiên về các dấu hiệu như sốt, rét run hoặc các phản ứng khác liên quan đến truyền dịch. Vị trí truyền cũng nên được giám sát chặt để tránh khả năng thuốc xâm nhiễm dưới da trong quá trình truyền thuốc (xem mục Cảnh báo, Tổng quát, Thoát mạch).
Nếu quá trình truyền dịch được dung nạp tốt, các liều Kadcyla tiếp theo có thể được truyền trong vòng 30 phút và bệnh nhân nên được theo dõi trong quá trình truyền và ít nhất 30 phút sau khi truyền dịch.
Kadcyla nên được truyền với tốc độ chậm hoặc ngừng truyền nếu bệnh nhân có các triệu chứng liên quan đến truyền dịch (xem mục Cảnh báo, Tổng quát). Ngừng dùng Kadcyla nếu có các phản ứng truyền dịch đe dọa tính mạng.
Chậm hoặc quên liều: Nếu liều được dự kiến bị bỏ lỡ, nên dùng thuốc càng sớm càng tốt mà không đợi đến liệu trình được dự kiến tiếp theo. Lịch dùng thuốc nên được điều chỉnh để duy trì khoảng cách 3 tuần giữa các liều. Thuốc có thể được truyền với tốc độ mà bệnh nhân dung nạp được ở lần truyền thuốc gần đây nhất.
Điều chỉnh liều: Việc kiểm soát các biến cố bất lợi có thể cần phải dừng thuốc tạm thời, giảm liều hoặc ngừng điều trị bằng Kadcyla được thực hiện theo hướng dẫn ở bảng 2-6.
Không nên tăng dần liều Kadcyla lại sau khi giảm liều cho bệnh nhân.
- xem Bảng 2 & Bảng 3.


(xem mục Cảnh báo, Tổng quát, Độc tính trên gan)
- xem Bảng 4.

(xem mục Cảnh báo, Tổng quát, Độc tính trên gan)
- xem Bảng 5.

(xem mục Cảnh báo, Tổng quát, Giảm tiểu cầu)
- xem Bảng 6.

(xem mục Cảnh báo, Tổng quát, Rối loạn chức năng thất trái)
Liều dùng trên các đối tượng đặc biệt
Người cao tuổi: Không cần điều chỉnh liều Kadcyla trên bệnh nhân ≥ 65 tuổi (xem mục Cảnh báo, Sử dụng trong lão khoa).
Trẻ em: Độ an toàn và hiệu quả của Kadcyla trên trẻ em chưa được thiết lập.
Suy thận
Không cần điều chỉnh liều khởi đầu của Kadcyla cho bệnh nhân suy thận nhẹ hoặc trung bình (xem mục Dược động học trên các quần thể đặc biệt).
Sự cần thiết phải điều chỉnh liều trên bệnh nhân suy thận nặng chưa được xác định do chưa có đầy đủ các dữ liệu.
Suy gan
Không cần chỉnh liều khởi đầu của Kadcyla cho bệnh nhân suy gan nhẹ hoặc vừa (xem mục Dược động trên các quần thể đặc biệt).
Kadcyla chưa được nghiên cứu trên bệnh nhân suy gan nặng.
Điều trị bệnh nhân suy gan cần được theo dõi chặt chẽ vì nhiễm độc gan do Kadcyla đã được ghi nhận (xem phần Cảnh báo).
4.3. Chống chỉ định:
Chống chỉ định dùng Kadcyla cho các bệnh nhân mẫn cảm với Kadcyla hoặc bất cứ thành phần nào của thuốc.
4.4 Thận trọng:
Tổng quát: Bệnh nhân được điều trị bằng Kadcyla nên được khẳng định có khối u dương tính với HER2 thông qua biểu hiện quá mức protein HER2 hoặc khuếch đại gen.
Độc tính trên phổi
Các trường hợp bệnh phổi mô kẽ, bao gồm cả viêm phổi, trong đó một vài trường hợp dẫn đến hội chứng suy hô hấp cấp hoặc dẫn đến tử vong đã được báo cáo trong các thử nghiệm lâm sàng với Kadcyla (xem mục Tác dụng ngoại ý). Các dấu hiệu và triệu chứng bao gồm khó thở, ho, mệt mỏi và thâm nhiễm phổi.
Việc ngừng điều trị vĩnh viễn với Kadcyla được khuyến cáo trong trường hợp bệnh nhân được chẩn đoán bị bệnh phổi kẽ hoặc viêm phổi.
Bệnh nhân khó thở lúc nghỉ do biến chứng của bệnh ác tính tiến triển và các bệnh kèm theo có thể bị tăng nguy cơ mắc các vấn đề về phổi.
Độc tính trên gan
Độc tính trên gan, chủ yếu dưới dạng tăng nồng độ các transaminase huyết thanh không có triệu chứng (tăng transaminase độ 1-4), đã được ghi nhận khi điều trị Kadcyla trong các thử nghiệm lâm sàng (xem mục Tác dụng ngoại ý). Nói chung tăng transaminase thì thoáng qua với tăng đỉnh điểm vào ngày thứ 8 sau điều trị và hồi phục về độ 1 hoặc nhẹ hơn trước khi đến chu kỳ tiếp theo. Tác dụng tích lũy của Kadcyla trên các transminase đã được ghi nhận. Phần lớn các trường hợp bệnh nhân có tăng transaminase sẽ được cải thiện về độ 1 hoặc bình thường trong vòng 30 ngày sau liều Kadcyla cuối cùng. Các rối loạn gan mật nghiêm trọng, bao gồm tăng sản tái tạo dạng nốt ở gan (NRH) và một số trường hợp có thể gây tử vong vì tổn thương gan do thuốc đã được quan sát ở các bệnh nhân được điều trị bằng Kadcyla trong các thử nghiệm lâm sàng. Các trường hợp đã quan sát thấy có thể bị gây nhiễu bởi các bệnh lý đi kèm và/hoặc các thuốc dùng đồng thời đã được biết là có khả năng gây độc cho gan.
Cần kiểm tra chức năng gan trước khi khởi đầu điều trị và trước mỗi liều Kadcyla. Giảm liều hoặc ngừng dùng thuốc do tăng transaminase huyết thanh và bilirubin toàn phần được nêu rõ ở mục Liều lượng và Cách dùng - Điều chỉnh liều. Kadcyla chưa được nghiên cứu trên bệnh nhân có transaminase huyết thanh > 2,5 lần so với giới hạn trên bình thường hoặc bilirubin toàn phần > 1,5 lần so với giới hạn trên bình thường trước khi bắt đầu điều trị. Nên ngừng vĩnh viễn việc điều trị bằng Kadcyla cho bệnh nhân có transaminase huyết thanh > 3 lần so với giới hạn trên bình thường và đồng thời có bilirubin toàn phần > 2 lần so với giới hạn trên ở mức bình thường.
Các trường hợp tăng sản tái tạo dạng nốt ở gan (NRH) đã được xác định bằng sinh thiết gan ở những bệnh nhân điều trị bằng Kadcyla. NRH là một tình trạng gan hiếm gặp đặc trưng bởi sự biến đổi lành tính lan rộng nhu mô gan thành các nốt tái tạo nhỏ, NRH có thể dẫn đến tăng áp lực tĩnh mạch cửa không do xơ gan. Chẩn đoán NRH chỉ có thể được xác định bằng giải phẫu bệnh học. NRH nên được xem xét ở các bệnh nhân có triệu chứng lâm sàng tăng áp lực tĩnh mạch cửa và/hoặc có các biểu hiện như kiểu xơ gan trên phim chụp CT gan nhưng có xét nghiệm transaminase bình thường và không có các biểu hiện khác của xơ gan. Sau khi chẩn đoán được xác định là NRH, phải ngừng điều trị Kadcyla vĩnh viễn.
Rối loạn chức năng thất trái: Bệnh nhân được điều trị bằng Kadcyla tăng nguy cơ bị các rối loạn chức năng thất trái. Phân suất tống máu thất trái (LVEF) < 40% đã được ghi nhận ở các bệnh nhân dùng Kadcyla và do đó suy tim sung huyết có triệu chứng (CHF) là một nguy cơ tiềm tàng. Các thử nghiệm đánh giá chức năng tim tiêu chuẩn (siêu âm tim hoặc chụp MUGA) nên được thực hiện trước khi bắt đầu dùng thuốc và định kỳ (ví dụ 3 tháng một lần) trong thời gian điều trị bằng Kadcyla. Điều trị bằng Kadcyla chưa được nghiên cứu trên bệnh nhân có LVEF < 50% trước khi bắt đầu điều trị. Các hướng dẫn đặc biệt về thay đổi liều và ngừng dùng thuốc được ghi trong phần Liều lượng và Cách dùng, Điều chỉnh liều.
Các phản ứng liên quan đến truyền dịch
Điều trị bằng Kadcyla chưa được nghiên cứu trên bệnh nhân đã từng dùng trastuzumab nhưng phải ngừng dùng do các phản ứng liên quan đến truyền dịch, Kadcyla không được khuyến cáo sử dụng cho các bệnh nhân này.
Các phản ứng liên quan đến truyền dịch, đặc trưng bởi một hoặc nhiều hơn các triệu chứng dưới đây: đỏ bừng, ớn lạnh, sốt, khó thở, hạ huyết áp, thở khò khè, co thắt phế quản và nhịp tim nhanh đã được báo cáo trong các thử nghiệm lâm sàng với Kadcyla. Nhìn chung, các triệu chứng này thường không nghiêm trọng (xem mục Tác dụng ngoại ý). Với đa số bệnh nhân, các phản ứng này thường thoái lui trong khoảng thời gian vài giờ đến một ngày sau khi kết thúc truyền dịch. Nên dừng điều trị bằng Kadcyla trong trường hợp bệnh nhân có các phản ứng nặng liên quan đến truyền dịch. Phải ngừng điều trị bằng Kadcyla vĩnh viễn nếu có các biến cố liên quan đến truyền dịch đe dọa tính mạng (xem mục Liều lượng và Cách dùng, Điều chỉnh liều).
Các phản ứng quá mẫn: Bệnh nhân nên được theo dõi chặt các phản ứng quá mẫn, đặc biệt trong lần truyền đầu tiên. Quá mẫn, bao gồm các phản ứng nghiêm trọng tương tự sốc phản vệ, đã được ghi nhận trong các thử nghiệm lâm sàng với Kadcyla. Các thuốc cũng như phương tiện cấp cứu cần thiết cho các phản ứng này cần sẵn có để có thể sử dụng ngay.
Xuất huyết: Các trường hợp xuất huyết, bao gồm hệ thần kinh trung ương, hô hấp, và xuất huyết tiêu hóa, đã được ghi nhận với Kadcyla. Một số trường hợp xuất huyết đã dẫn đến tử vong. Trong một số trường hợp, bệnh nhân cũng được điều trị đồng thời với thuốc chống đông, chống kết tập tiểu cầu, hoặc giảm tiểu cầu, ở những bệnh nhân khác không có các yếu tố nguy cơ khác được biết đến. Cần thận trọng với các yếu tố này và xem xét theo dõi thêm khi phải sử dụng đồng thời các thuốc khác.
Giảm tiểu cầu
Giảm tiểu cầu đã được báo cáo ở các bệnh nhân trong các thử nghiệm lâm sàng với Kadcyla. Phần lớn các bệnh nhân này gặp các biến cố ở mức độ 1 hoặc 2 (≥ 50.000/mm3), với số lượng tiểu cầu thấp nhất xảy ra vào ngày thứ 8 và thường cải thiện trở về mức độ 0 hoặc 1 (≥ 75.000/mm3) trước lịch trình kế tiếp. Trong các thử nghiệm lâm sàng, tỷ lệ mắc và mức độ nghiêm trọng của giảm tiểu cầu cao hơn ở các bệnh nhân châu Á.
Nên theo dõi chặt bệnh nhân bị giảm tiểu cầu (≤ 100.000/mm3) và bệnh nhân đang điều trị bằng các thuốc chống đông trong quá trình điều trị với Kadcyla. Việc theo dõi số lượng tiểu cầu trước mỗi liều Kadcyla đươc khuyến cáo. Kadcyla chưa được nghiên cứu trên bệnh nhân có số lượng tiểu cầu ≤ 100.000/mm3 trước khi bắt đầu điều trị. Trong trường hợp giảm tiểu cầu mức độ 3 hoặc cao hơn (< 50.000/mm3), không dùng Kadcyla cho đến khi số lượng tiểu cầu trở về mức độ 1 (≥ 75.000/mm3). Xem phần Liều lượng và Cách dùng, Thay đổi liều.
Độc tính trên hệ thần kinh: Các bệnh lý thần kinh ngoại vi, chủ yếu ở độ 1 và phần lớn liên quan đến cảm giác, đã được ghi nhận trong các thử nghiệm lâm sàng với Kadcyla. Nên tạm thời dừng điều trị với Kadcyla trên các bệnh nhân có biểu hiện bệnh lý thần kinh ngoại vi độ 3 hoặc 4 cho đến khi hết các triệu chứng hoặc các triệu chứng cải thiện xuống dưới độ 2. Bệnh nhân cần được theo dõi trên lâm sàng về tiến triển các dấu hiệu/triệu chứng độc tính thần kinh.
Thoát mạch: Trong các nghiên cứu lâm sàng với Kadcyla, các phản ứng do thoát mạch gây ra đã được quan sát thấy. Các phản ứng này thường nhẹ và bao gồm đỏ da, đau, kích ứng da, đau hoặc sưng tại chỗ truyền. Các phản ứng này thường được quan sát thấy trong vòng 24 giờ sau khi truyền. Hiện nay, chưa có điều trị đặc hiệu trong trường hợp thoát mạch Kadcyla. Vị trí truyền dịch nên được theo dõi chặt về khả năng thoát mạch dưới da trong quá trình truyền thuốc.
Các xét nghiệm: Xem phần Cảnh báo, Tổng quát, Độc tính trên gan, Giảm tiểu cầu.
Sử dụng thuốc cho trẻ em: Độ an toàn và hiệu quả của Kadcyla trên trẻ em dưới 18 tuổi chưa được thiết lập.
Sử dụng thuốc cho người cao tuổi: Chưa có đủ các dữ liệu về độ an toàn và hiệu quả của Kadcyla trên bệnh nhân từ 75 tuổi trở lên.
Bệnh nhân suy thận: Xem mục Liều dùng trên các đối tượng đặc biệt và Dược động học của thuốc trên các nhóm bệnh nhân đặc biệt.
Bệnh nhân suy gan: Xem mục Liều dùng trên các đối tượng đặc biệt và Dược động học của thuốc trên những quần thể đặc biệt.
Tác động của thuốc trên người lái xe và vận hành máy móc.
Khả năng lái xe và vận hành máy móc: Các nghiên cứu về ảnh hưởng của thuốc trên khả năng lái xe và vận hành máy móc chưa được thực hiện.
4.5 Sử dụng cho phụ nữ có thai và cho con bú:
Xếp hạng cảnh báo
AU TGA pregnancy category: D
US FDA pregnancy category: NA
Thời kỳ mang thai:
Chưa có các nghiên cứu lâm sàng về sử dụng Kadcyla trên phụ nữ có thai. Chưa có các nghiên cứu về độc tính trên sinh sản và phát triển được thực hiện với Kadcyla.
Trastuzumab, một thành phần của Kadcyla, có thể gây hại hoặc tử vong cho thai nhi khi sử dụng thuốc cho phụ nữ có thai. Trong các thông tin sau khi đưa thuốc được ra thị trường, các trường hợp thiểu ối, trong đó một số trường hợp liên quan đến giảm sản phổi gây tử vong, đã được ghi nhận trên phụ nữ có thai được dùng trastuzumab. Các nghiên cứu trên động vật với maytansine, một hóa chất có liên quan chặt chẽ với thuộc nhóm maytansinoid, cho thấy DM1, một thành phần của Kadcyla có độc tính tế bào thông qua ức chế vi ống, được cho là gây quái thai và có khả năng gây độc cho bào thai.
Không khuyến cáo dùng Kadcyla cho phụ nữ có thai. Phụ nữ nếu biết có thai cần liên lạc với bác sĩ và cần được tư vấn về khả năng gây hại của thuốc đối với bào thai. Nếu phụ nữ có thai được điều trị bằng Kadcyla, khuyến khích việc theo dõi chặt chẽ bệnh nhân bởi các bác sĩ thuộc nhiều chuyên khoa khác nhau.
Phụ nữ có khả năng mang thai: Bệnh nhân nên được tư vấn sử dụng các biện pháp tránh thai có hiệu quả trong thời gian điều trị bằng Kadcyla và ít nhất 7 tháng sau khi kết thúc điều trị.
Thời kỳ cho con bú:
Hiện chưa biết rõ Kadcyla có bài tiết qua sữa mẹ hay không. Do có nhiều thuốc được bài tiết qua sữa mẹ và khả năng của Kadcyla gây các phản ứng có hại nghiêm trọng trên trẻ bú mẹ, các bà mẹ nên ngừng cho con bú trước khi bắt đầu điều trị bằng Kadcyla. Có thể bắt đầu cho con bú lại 7 tháng sau khi kết thúc điều trị.
4.6 Tác dụng không mong muốn (ADR):
Các thử nghiệm lâm sàng
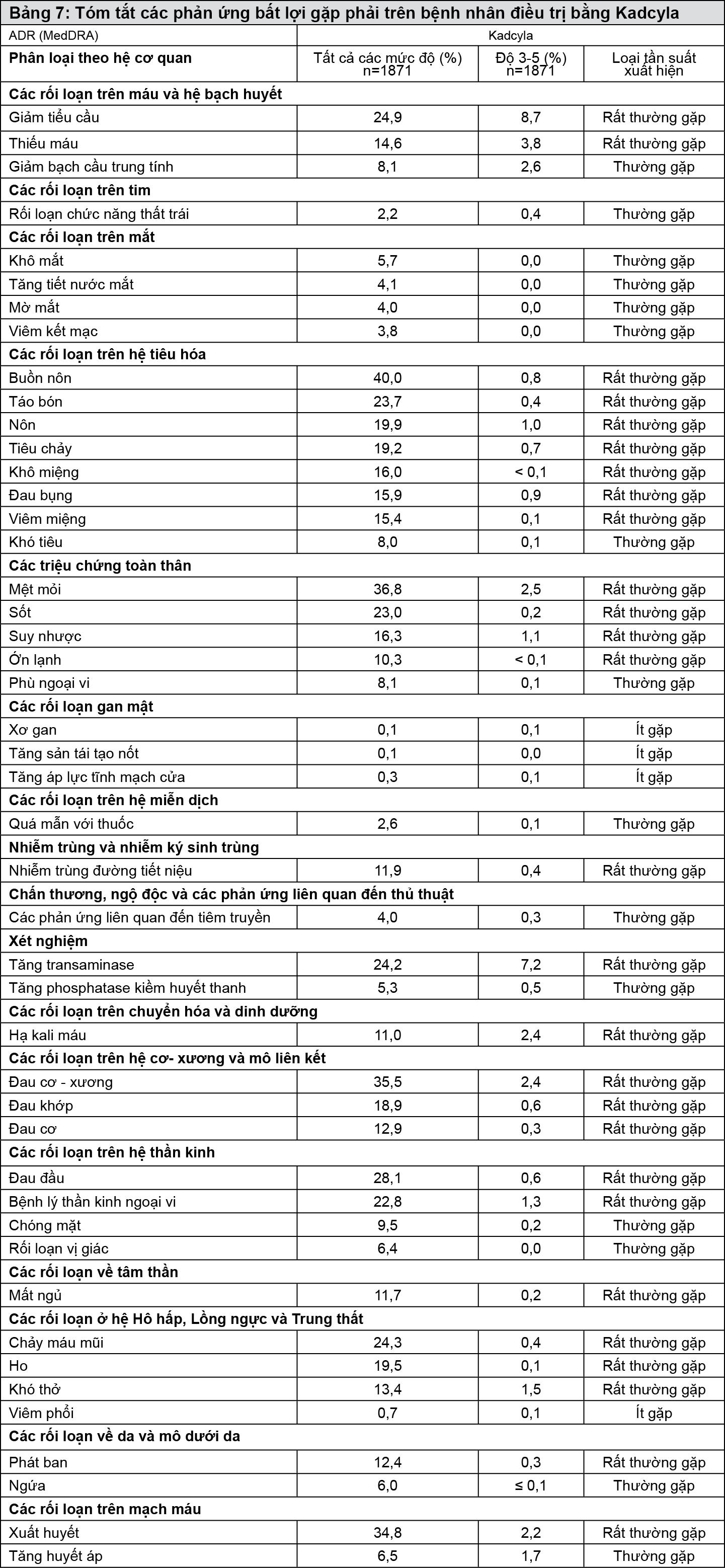
Độ an toàn của Kadcyla được đánh giá ở 1871 bệnh nhân trong các thử nghiệm lâm sàng. Bảng 7 tóm tắt các phản ứng bất lợi của thuốc (ADR) đã được báo cáo có liên quan đến Kadcyla trong các thử nghiệm lâm sàng.
Trong phần này, cách phân loại về tần suất sau đây được dùng: rất thường gặp (≥1/10), thường gặp (≥1/100 đến <1/10), ít gặp (≥1/1000 đến <1/100).
- xem Bảng 7.
Các bất thường về kết quả xét nghiệm: Bảng 8 mô tả các bất thường trong kết quả xét nghiệm quan sát được trên bệnh nhân điều trị bằng Kadcyla trong thử nghiệm lâm sàng TDM4370g/BO21977.
- xem Bảng 8.

Thông báo cho Bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
4.7 Hướng dẫn cách xử trí ADR:
Tạm ngừng hoặc ngừng hẳn trastuzumab nếu bệnh nhân bị ADR nặng hoặc ADR nguy hiểm tới tính mạng.
Xử trí ADR chủ yếu là điều trị triệu chứng, điều trị hỗ trợ và can thiệp tùy theo từng trường hợp mắc.
Đặt ống nội khí quản nếu bị tác dụng các phản ứng lên đường hô hấp do truyền thuốc (suy hô hấp cấp, ức chế trung tâm thần kinh). Phản ứng phản vệ: Dùng kháng histamin nếu nặng vừa; mở thông đường thở, noradrenalin, theo dõi tim, truyền dịch.
4.8 Tương tác với các thuốc khác:
Chưa có các nghiên cứu chính thức về tương tác thuốc-thuốc với Kadcyla trên người được thực hiện. Các nghiên cứu chuyển hóa về thực nghiệm trên ty thể gan người cho thấy DM1, một thành phần của trastuzumab emtasine, được chuyển hóa chủ yếu bởi CYP3A4, và một phần được chuyển hóa bởi CYP3A5. DM1 không gây cảm ứng hoặc ức chế chuyển hóa qua trung gian P450 về thực nghiệm. Cần thận trọng khi dùng Kadcyla cùng các thuốc ức chế CYP3A mạnh.
4.9 Quá liều và xử trí:
Chưa có các thuốc giải độc khi quá liều trastuzumab emtansine. Trong trường hợp quá liều, cần theo dõi chặt bệnh nhân. Các trường hợp quá liều được ghi nhận khi điều trị bằng trastuzumab emtansine hầu hết liên quan đến giảm tiểu cầu, trong đó có 1 trường hợp tử vong. Trong trường hợp tử vong này, bệnh nhân dùng không đúng liều trastuzumab emtasine với 10 liều 6 mg/kg và tử vong khoảng 3 tuần sau khi dùng quá liều; nguyên nhân tử vong và mối liên quan với Kadcyla chưa được thiết lập.
5.1. Dược lực học:
Các nghiên cứu lâm sàng/Hiệu quả của thuốc
Hiệu quả
Ung thư vú di căn
Một nghiên cứu lâm sàng mở, pha III, ngẫu nhiên, đa trung tâm, đa quốc gia (TDM4370g/BO21977) đã được thực hiện trên bệnh nhân ung thư vú dương tính với HER2 tại chỗ tiến triển không thể phẫu tích được hoặc ung thư vú di căn đã được điều trị bằng taxan và trastuzumab, bao gồm cả các bệnh nhân đã được điều trị bằng trastuzumab và một taxan để bổ trợ và các bệnh nhân này bị tái phát trong vòng 6 tháng sau khi kết thúc điều trị bổ trợ. Trước khi tham gia vào nghiên cứu, các mẫu khối u vú được yêu cầu phải xác nhận cho trung tâm dương tính với HER2 khi điểm IHC 3+ hoặc khi khuyếch đại gen bằng phương pháp lai tại chỗ (ISH). Đặc điểm của bệnh nhân và khối u được thì cân bằng giữa các nhóm điều trị. Đối với các bệnh nhân được phân ngẫu nhiên vào nhóm Kadcyla, giá trị trung vị của tuổi là 53 tuổi, hầu hết là phụ nữ (99,8%), phần lớn là người da trắng (72%) và 57% có thụ thể estrogen và/hoặc progesteron dương tính. Nghiên cứu này so sánh độ an toàn và hiệu quả của Kadcyla so với lapatinib kết hợp với capecitabine. Tổng số 991 bệnh nhân được phân nhóm ngẫu nhiên dùng Kadcyla hoặc lapatinib kết hợp với capecitabine như sau:
Nhóm Kadcyla: Kadcyla 3,6 mg/kg truyền tĩnh mạch trong vòng 30-90 phút vào ngày thứ nhất của liệu trình 21 ngày.
Nhóm chứng (lapatinib kết hợp capecitabin): lapatinib 1250 mg/ngày uống một lần trong ngày trong liệu trình 21 ngày kết hợp với capecitabin 1000 mg/m2 uống 2 lần trong ngày vào ngày 1-14 của liệu trình 21 ngày.
Các tiêu chí chính đánh giá hiệu quả là thời gian sống bệnh không tiến triển (PFS) được đánh giá bởi một hội đồng đánh giá độc lập, tỷ lệ sống còn toàn bộ và tỷ lệ sống còn có ý nghĩa quyết định (sau 1 năm và 2 năm).
Thời gian cho đến lúc triệu chứng tiến triển, được định nghĩa bằng giảm 5 điểm trong thang điểm phụ chỉ số vú trong kết cục thử nghiệm lâm sàng (trial outcome index-breast-TOI-B) của bộ câu hỏi đánh giá chất lượng cuộc sống trong điều trị ung thư vú (FACT-B QoL) cũng được đánh giá trong thử nghiệm lâm sàng này. Sự thay đổi 5 điểm trong TOI-B được xem là có ý nghĩa lâm sàng.
- xem Bảng 1.
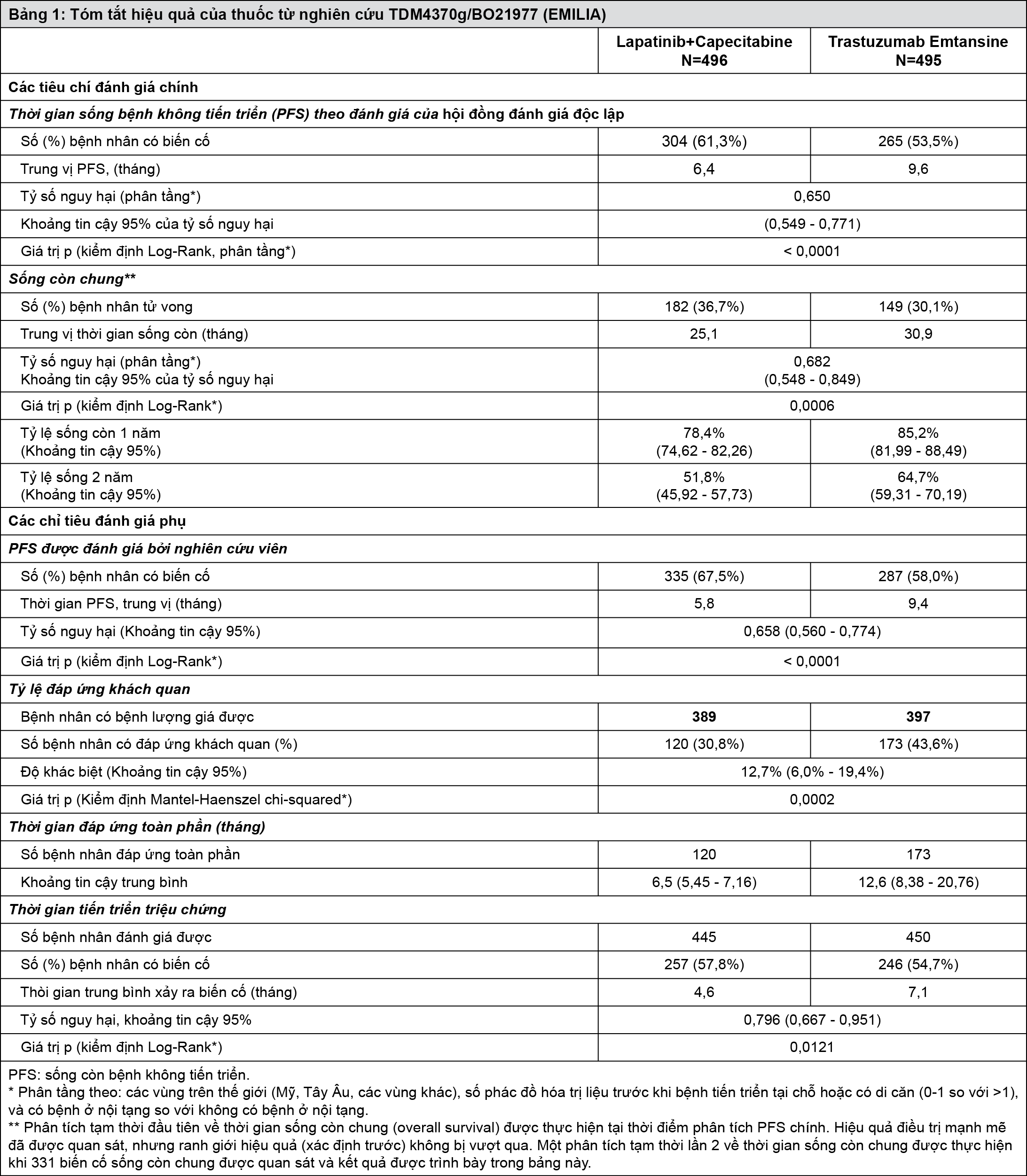
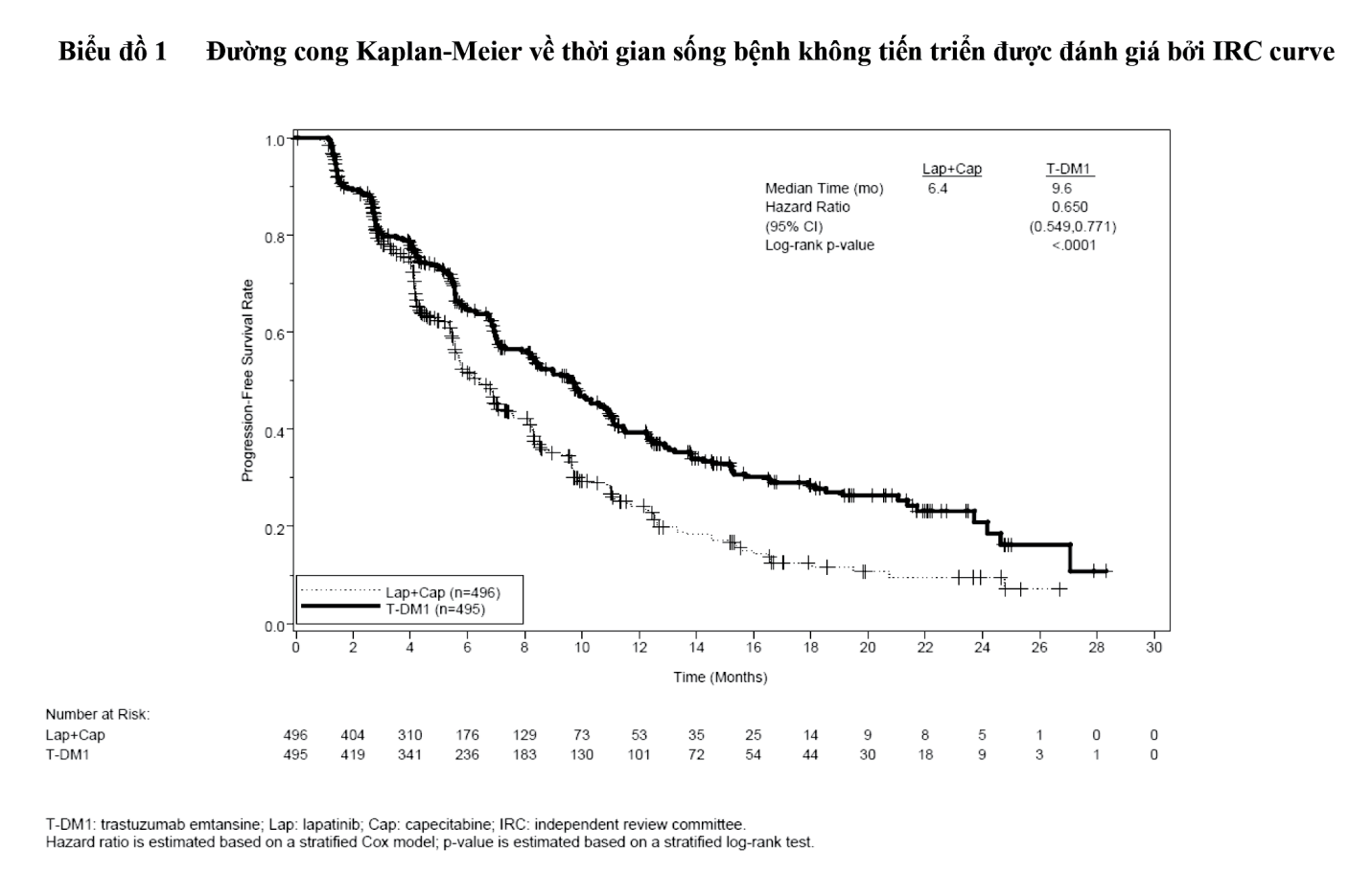
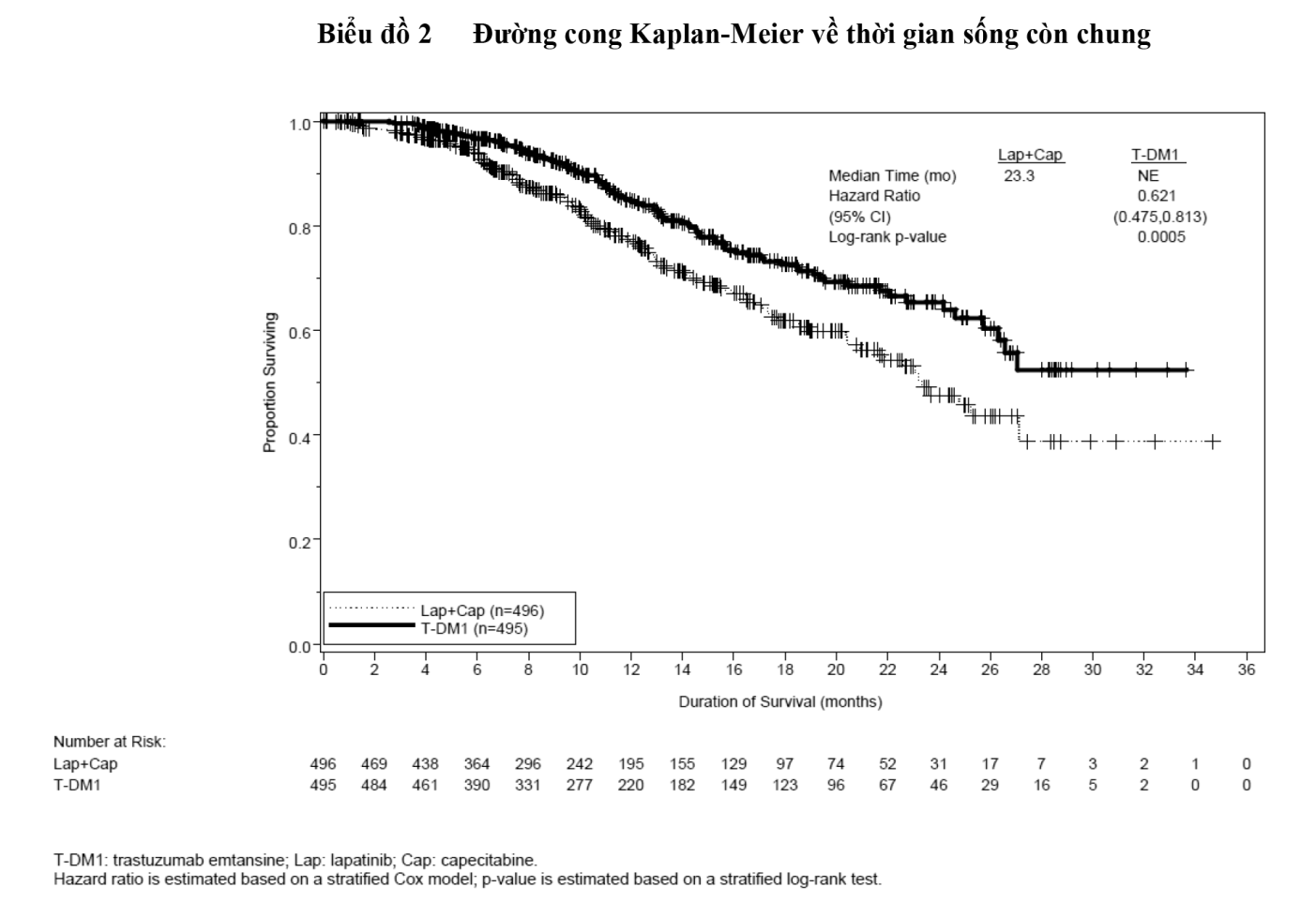
Hiệu quả điều trị đã được xem xét ở phân nhóm bệnh nhân chưa từng được điều trị chống ung thư đường toàn thân trước đó ở bệnh nhân có di căn (n=118); tỷ số nguy hại đối với sống bệnh không tiến triển (PFS) và sống còn chung (OS) lần lượt là 0,51 (khoảng tin cậy 95%: 0,30-0,85) và 0,61 (khoảng tin cậy 95%: 0,32-1,16). Giá trị trung vị của PFS và OS trong nhóm Kadcyla tương ứng là 10,8 tháng và không đạt được, so với 5,7 tháng và 27,9 tháng tương ứng đối với nhóm dùng lapatinib kết hợp capecitabine.
- xem Hình 1 & Hình 2.
Một nghiên cứu lâm sàng pha II ngẫu nhiên, đa trung tâm, mở (TDM4450g/BO21976) đã đánh giá tác dụng của Kadcyla so với trastuzumab phối hợp với docetaxel ở bệnh nhân ung thư vú di căn có HER2 dương tính chưa dùng hóa trị liệu để điều trị di căn trước đó. Bệnh nhân được phân ngẫu nhiên vào nhóm truyền tĩnh mạch Kadcyla 3,6 mg/kg mỗi 3 tuần (n=67) hoặc trastuzumab truyền tĩnh mạch liều ban đầu 8 mg/kg, tiếp theo truyền tĩnh mạch 6 mg/kg mỗi 3 tuần kết hợp với docetaxel 75-100 mg/m2 mỗi 3 tuần (n=70).
Tiêu chí chính là PFS, được đánh giá bởi nghiên cứu viên. Giá trị trung vị của PFS là 9,2 tháng đối với nhóm trastuzumab phối hợp docetaxel và 14,2 tháng đối với nhóm dùng Kadcyla (tỷ số nguy hại là 0,59; p=0,035), với trung vị thời gian theo dõi là khoảng 14 tháng đối với cả hai nhóm. ORR là 58,0% đối với nhóm dùng trastuzumab kết hợp docetaxel và 64,2% đối với nhóm dùng Kadcyla. Thời gian đáp ứng không đạt được với Kadcyla so với trung vị thời gian 9,5 tháng ở nhóm chứng.
Điểm FACT-B TOI xấu đi chậm hơn ở nhóm dùng Kadcyla so với nhóm chứng (trung vị thời gian để triệu chứng tiến triển là 7,5 tháng đối với nhóm dùng Kadcyla so với 3,5 tháng ở nhóm chứng; tỷ số nguy hại là 0,58; p=0,022).
Một nghiên cứu lâm sàng pha II, một nhóm, mở (TDM4374g) đã đánh giá tác dụng của Kadcyla trên bệnh nhân ung thư vú tại chỗ tiến triển không thể chữa lành hoặc ung thư vú di căn, có HER2 dương tính. Các bệnh nhân này đều được điều trị trước đó bằng các thuốc nhắm vào HER2 (trastuzumab và lapatinib) kết hợp hóa trị liệu (anthracyclin, taxan, và capecitabin) trong điều trị tân bổ trợ, bổ trợ trên bệnh nhân có tiến triển tại chỗ hoặc có di căn. Trung vị của số lượng thuốc chống ung thư mà bệnh nhân sử dụng trong bất cứ tình trạng bệnh nào là 8,5 (từ 5-19) và trong tình trạng di căn là 7,0 (từ 3-17), bao gồm tất cả các thuốc dự định dùng để điều trị ung thư vú.
Bệnh nhân (n=110) dùng Kadcyla truyền tĩnh mạch với liều 3,6 mg/kg 3 tuần một lần cho đến khi bệnh tiến triển hoặc bệnh nhân không chịu được độc tính của thuốc.
Phân tích hiệu quả chính của thuốc là tỷ lệ đáp ứng chung dựa trên hình ảnh X-quang độc lập và thời gian đáp ứng với điều trị. Tỷ lệ đáp ứng chung là 32,7% (khoảng tin cậy 95%: 24,1-42,1), số bệnh nhân đáp ứng n=36, theo đánh giá của cả hội đồng đánh giá độc lập (IRC) và nghiên cứu viên. Thời gian đáp ứng trung bình theo IRC chưa xác định được [khoảng tin cậy 95% = (4,6 tháng cho đến thời gian chưa ước lượng được)].
Tính sinh miễn dịch
Như tất cả các protein dùng cho trị liệu, có thể có đáp ứng miễn dịch với trastuzumab emtansine. Trong số 836 bệnh nhân từ 6 thử nghiệm lâm sàng đã thử nghiệm tại nhiều thời điểm về đáp ứng kháng thể kháng trị liệu (ATA) với Kadcyla, 44 bệnh nhân (5,3%) kiểm tra thấy dương tính với kháng thể kháng Kadcyla tại một hoặc nhiều thời điểm sau dùng thuốc, 28 trong số những bệnh nhân này có mức ban đầu âm tính. Ý nghĩa lâm sàng của của kháng thể kháng trastuzumab emtansine chưa được biết rõ.
Các kết quả phân tích tính miễn dịch phụ thuộc rất lớn vào một số yếu tố như độ nhạy và độ đặc hiệu của thử nghiệm, phương pháp thử nghiệm, cách lấy mẫu, thời gian lấy mẫu, các thuốc dùng đồng thời và các bệnh tiềm ẩn. Vì những lý do đó, so sánh tỷ lệ kháng thể với Kadcyla và tỷ lệ kháng thể với các thuốc khác có thể bị sai lệch.
Cơ chế tác dụng:
Kadcyla, trastuzumab emtansine, là một thuốc kháng thể kết hợp nhắm vào HER2 trong đó có IgG1 kháng HER2 được tạo ra bằng kỹ thuật nhân hóa, liên kết đồng hóa trị với thuốc ức chế vi ống DM1 (dẫn chất của maytansin) qua dây nối thioether bền MCC (4-[N-maleimidomethyl] cyclohexane-1-carboxylate). Emtansine là một phức hợp MCC-DM1. Trung bình 3,5 phân tử DM1 được gắn với một phân tử trastuzumab.
Sự liên hợp của DM1 với trastuzumab cho thấy tác dụng độc tế bào chọn lọc đối với các tế bào u trình diện HER2 quá mức, do đó làm tăng vận chuyển DM1 nội bào trực tiếp trên các tế bào ung thư. Khi liên kết với HER2, trastuzumab emtansine được đưa vào trong tế bào qua trung gian receptor và sau đó giáng hóa lysosom, làm phóng thích cơ chất gây độc tế bào chứa DM1 (chủ yếu là lysin-MCC-DM1).
Kadcyla có cơ chế tác dụng của cả trastuzumab và DM1.
Trastuzumab emtansine, tương tự như trastuzumab, kết hợp với vùng IV của khu vực HER2 ngoại bào, cũng như với các thụ thể Fcγ và bổ thể C1q. Ngoài ra, tương tự trastuzumab, Kadcyla ức chế sự phát tán của HER2 ngoại bào, ức chế sự truyền tín hiệu qua con đường phosphatidylinositol 3-kinase (PI3-K), và gián tiếp gây độc tính tế bào qua trung gian tế bào phụ thuộc kháng thể trên các tế bào ung thư vú có trình diện HER2 quá mức.
DM1, một thành phần gây độc tế bào của Kadcyla, liên kết với tubulin. Bằng cách ức chế sự trùng hợp (polyme hóa) tubulin, cả DM1 và Kadcyla đều làm ngừng sự nhân lên của tế bào ở pha G2/M trong chu trình phát triển của tế bào, dẫn đến làm chết tế bào theo lập trình. Kết quả thử độc tính tế bào trên thực nghiệm cho thấy rằng DM1 mạnh hơn taxan và các vinca alcaloid 20-200 lần.
Cầu nối MCC được thiết kế để hạn chế việc giải phóng thuốc toàn thân và tăng giải phóng DM1 tại đích tác dụng, đã được chứng minh thông qua việc tìm thấy DM1 tự do ở nồng độ rất thấp trong huyết tương.
[XEM TẠI ĐÂY]
5.2. Dược động học:
Hấp thu: Kadcyla được dùng theo đường truyền tĩnh mạch. Thuốc chưa được nghiên cứu sử dụng theo đường khác.
Phân bố:
Khi dùng Kadcyla theo đường truyền tĩnh mạch mỗi 3 tuần cho thấy động học tuyến tính của thuốc tăng trong khoảng liều từ 2,4 đến 4,8 mg/kg; bệnh nhân dùng liều thấp hơn hoặc bằng 1,2 mg/kg có tốc độ thanh thải nhanh hơn.
Bệnh nhân trong thử nghiệm lâm sàng TDM4370g/BO21977 dùng Kadcyla truyền tĩnh mạch với liều 3,6 mg/kg mỗi 3 tuần có nồng độ trastuzumab emtansine tối đa trung bình là 83,4 (±16,5) μg/ml. Trên cơ sở phân tích dược động học quần thể, sau khi truyền tĩnh mạch, thể tích phân bố trung tâm của trastuzumab emtansine là 1,13 l và xấp xỉ với thể tích trong huyết tương.
Chuyển hóa:
Trastuzumab emtansine được cho là trải qua một quá trình dị hóa bằng cách thủy phân protein trong lysosome của tế bào với sự tham gia không đáng kể của isoenzym cytochrome P450. Các chất chuyển hóa bao gồm Lys-MCC-DM1, MCC-DM1 và DM1 đã được tìm thấy ở nồng độ thấp trong huyết tương bệnh nhân. Trong nghiên cứu lâm sàng TDM4370g/BO21977, nồng độ DM1 tối đa trong vòng chuyển hóa đầu sau khi dùng Kadcyla luôn thấp và trung bình là 4,61±0,161 ng/ml.
Các nghiên cứu chuyển hóa trên thực nghiệm ở ty thể gan người cho thấy DM1, một thành phần của trastuzumab emtansine, được chuyển hóa chủ yếu bởi CYP3A4 và một phần nhỏ hơn bởi CYP3A.
Thải trừ:
Dựa trên phân tích dược động học quần thể, sau khi truyền tĩnh mạch Kadcyla trên bệnh nhân ung thư vú di căn có HER2 dương tính, độ thanh thải của Kadcyla là 0,68 l/ngày và thời gian bán thải (t1/2) xấp xỉ 4 ngày. Kadcyla không bị tích lũy sau khi dùng liều truyền tĩnh mạch lặp lại mỗi 3 tuần.
Dựa trên phân tích dược động học quần thể (n=671), trọng lượng cơ thể, albumin, tổng số đường kính lớn nhất của sang thương đích theo RECIST, HER2 ECD, nồng độ trastuzumab ban đầu và AST được xác định là các đồng biến số (covariate) có ý nghĩa thống kê đối với các thông số dược động học của trastuzumab emtansine. Tuy nhiên, mức độ tác động của các biến số này trên độ phơi nhiễm trastuzumab emtansine, ngoại trừ trọng lượng cơ thể, cho thấy rằng các biến số còn lại hầu như không có ý nghĩa lâm sàng trên sự phơi nhiễm KADCYLA. Do đó, liều dùng 3,6 mg/kg tính theo trọng lượng cơ thể mỗi 3 tuần mà không có sự điều chỉnh đối với các biến số khác được cho là phù hợp. Trong các nghiên cứu tiền lâm sàng, các chất chuyển hóa của trastuzumab emtansine bao gồm DM1, Lys-MCC-DM1 và MCC-DM1 được thải trừ chủ yếu qua mật, một phần tối thiểu thải trừ qua nước tiểu.
Dược động học trên những quần thể đặc biệt: Phân tích dược động học quần thể của Kadcyla cho thấy chủng tộc có vẻ như không có ảnh hưởng đến dược động học của Kadcyla. Do hầu hết các bệnh nhân trong nghiên cứu lâm sàng của Kadcyla là phụ nữ, ảnh hưởng của giới tính đến dược động học của Kadcyla chưa được đánh giá chính thức.
Sử dụng thuốc trên người cao tuổi: Các phân tích dược động học quần thể của Kadcyla cho thấy tuổi không ảnh hưởng đến dược động học của thuốc. Sự khác biệt không có ý nghĩa đã được quan sát thấy trên dược động học của Kadcyla giữa các nhóm bệnh nhân < 65 tuổi (n=577), bệnh nhân từ 65 đến 75 tuổi (n=78) và bệnh nhân > 75 tuổi (n=16).
Bệnh nhân suy thận: Các phân tích dược động học quần thể của Kadcyla cho thấy độ thanh thải creatinin không ảnh hưởng đến dược động học của Kadcyla. Dược động học của Kadcyla trên bệnh nhân suy thận nhẹ (độ thanh thải creatinin - CLcr = 60-89 ml/phút, n=254) hoặc trung bình (CLcr = 30-59 ml/phút, n=53) tương tự trên bệnh nhân có chức năng thận bình thường (CLcr ≥ 90ml/phút, n=361). Các dữ liệu dược động học trên bệnh nhân suy thận nặng (CLcr 15-29ml/phút) bị hạn chế (n=1), do đó không đưa ra được các khuyến cáo về liều trong trường hợp này.
Bệnh nhân suy gan: DM1 và các chất chuyển hóa có chứa DM1 được thải trừ chủ yếu qua gan. Dược động học của trastuzumab emtansine và các chất chất chuyển hóa có chứa DM1 đã được đánh giá sau khi dùng Kadcyla liều 3,6 mg/kg trên bệnh nhân ung thư vú di căn có HER2 dương tính có chức năng gan bình thường (n=10), suy gan nhẹ (Child-Pugh A; n=10) và trung bình (Child-Pugh B; n=8).
Nồng độ huyết tương của DM1 và các chất chuyển hóa có chứa DM1 (Lys-MCC-DM1 và MCC-DM1) là thấp và tương đương giữa bệnh nhân suy gan và không suy gan.
Sự phơi nhiễm với trastuzumab emtansine hệ thống (AUC) ở chu kỳ dùng thuốc đầu tiên ở bệnh nhân suy gan nhẹ và trung bình thấp hơn khoảng 38% và 67% so với những bệnh nhân có chức năng gan bình thường. Sự phơi nhiễm với trastuzumab emtansine (AUC) ở chu kỳ thứ 3 sau khi dùng lặp lại ở những bệnh nhân rối loạn chức năng gan nhẹ hoặc trung bình nằm trong khoảng giá trị đã được quan sát thấy ở những bệnh nhân có chức năng gan bình thường.
Kadcyla chưa được nghiên cứu ở bệnh nhân suy gan nặng (Child-Pugh nhóm C).
5.3 Giải thích:
Chưa có thông tin. Đang cập nhật.
5.4 Thay thế thuốc :
Chưa có thông tin. Đang cập nhật.
*Lưu ý:
Các thông tin về thuốc trên Pharmog.com chỉ mang tính chất tham khảo - Khi dùng thuốc cần tuyệt đối tuân theo theo hướng dẫn của Bác sĩ
Chúng tôi không chịu trách nhiệm về bất cứ hậu quả nào xảy ra do tự ý dùng thuốc dựa theo các thông tin trên Pharmog.com
6.1. Danh mục tá dược:
Thuốc thường đi kèm nước kìm khuẩn để pha tiêm có chứa benzyl alcohol
6.2. Tương kỵ :
Không nên sử dụng dung dịch dextrose (5%) vì dung dịch này gây kết tủa protein.
Không nên trộn lẫn hoặc pha loãng trastuzumab emtansine với các thuốc khác.
6.3. Bảo quản:
Lọ thuốc: Bảo quản lọ thuốc ở nhiệt độ 2-8°C.
Thời hạn sử dụng của dung dịch sau khi pha
Nên sử dụng ngay thuốc sau khi pha với nước vô trùng để truyền tĩnh mạch. Trong trường hợp chưa sử dụng thuốc ngay, dung dịch được pha cần được bảo quản không quá 24 giờ ở 2-8oC và phải được loại bỏ sau thời gian đó.
Không để đông lạnh dung dịch sau khi pha.
Thời hạn sử dụng của dịch truyền có chứa thuốc sau khi pha
Dung dịch trastuzumab emtansine sau khi pha được hòa loãng trong túi dịch truyền polyvinyl chlorid (PVC) hoặc túi polyolefin không có thành phần latex và PVC chứa dung dịch natri chlorid 0,9% để tiêm truyền hoặc dịch truyền natri clorid 0,45% có thể bảo quản ở nhiệt độ 2-8oC trong vòng 24 giờ trước khi sử dụng. Có thể quan sát thấy các hạt trong quá trình bảo quản trong trường hợp pha loãng thuốc với dung dịch truyền natri chlorid 0,9%, do đó cần lọc qua màng lọc 0,2 hoặc 0,22 micron polyethersulfone (PES) trước khi sử dụng (xem mục Hướng dẫn đặc biệt cho Sử dụng, Pha chế và Xử lý).
Không để đông lạnh dịch truyền có chứa thuốc sau khi pha.
6.4. Thông tin khác :
An toàn tiền lâm sàng
Tính gây quái thai
Khả năng gây ung thư: Trastuzumab emtansine chưa được thử nghiệm về khả năng gây ung thư.
Khả năng gây đột biến gen: Không có bằng chứng về tác dụng gây đột biến gen của thuốc được quan sát thấy trong thử nghiệm đột biến ngược của vi khuẩn. Trong thử nghiệm vi nhân (micronucleus assay) trên cơ thể sống với trastuzumab emtamsine ở khỉ đuôi dài (cynomolgus monkey), không có bằng chứng về tổn thương nhiễm sắc thể cũng như các tế bào tủy xương được quan sát thấy. Tuy nhiên, trên thử nghiệm vi nhân ở tủy xương chuột cống, DM1 thì dương tính với việc hình thành vi nhân sau khi sử dụng một liều thấp trong khoảng nồng độ DM1 đo được trên bệnh nhân dùng trastuzumab emtansine, khẳng định rằng trastuzumab emtansine là một tác nhân gây bất thường số lượng nhiễm sắc thể (aneugen) và/hoặc làm mất đoạn, thêm đoạn hoặc chuyển đoạn nhiễm sắc thể (clastogen).
Suy giảm khả năng sinh sản: Chưa có nghiên cứu về khả năng sinh sản được tiến hành đối với trastuzumab emtansine. Tuy nhiên, dựa trên kết quả từ các nghiên cứu độc tính chung trên động vật, tác dụng bất lợi trên khả năng sinh sản có thể được mong đợi.
Khả năng gây quái thai: Chưa có các nghiên cứu về sự phát triển của thai nhi dành riêng được tiến hành đối với trastuzumab emtansine. Độc tính trên sự phát triển của thai nhi của trastuzumab đã được nhận ra trên lâm sàng mặc dù độc tính này không được dự báo trong các nghiên cứu phi lâm sàng. Thêm vào đó, độc tính trên sự phát triển thai nhi của maytansine đã được nhận biết trên các nghiên cứu tiền lâm sàng cho thấy DM1, một thành phần của trastuzumab emtansine thuộc nhóm maytansinoid gây độc tế bào thông qua ức chế vi ống, có khả năng gây quái thai tương tự và có khả năng gây độc tính trên thai nhi.
6.5 Tài liệu tham khảo:
Dược Thư Quốc Gia Việt Nam
Hoặc HDSD Thuốc.
Bài viết được sưu tầm hoặc viết bởi: Bác sĩ nhi khoa - Đỗ Mỹ Linh.
Kiểm duyệt , hiệu đính và đăng tải: PHARMOG TEAM


